
| n |
| V |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
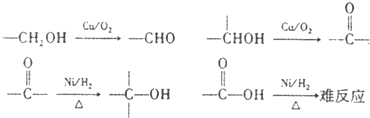
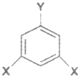 (化学一选修5:有机化学基础)
(化学一选修5:有机化学基础)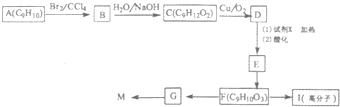
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、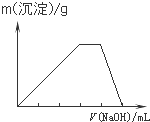 |
B、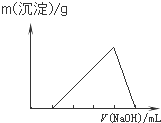 |
C、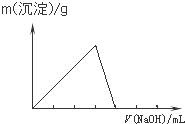 |
D、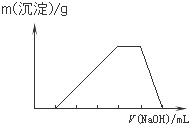 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲∠乙∠丙∠丁 |
| B、丁∠甲∠丙=乙 |
| C、甲=丁∠丙=乙 |
| D、丁∠甲∠乙∠丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g/cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |

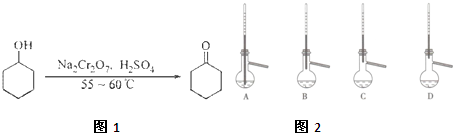
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
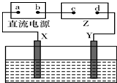 如图,Z为浸透饱和食盐水和酚酞试液的滤纸,水槽中盛有足量CuSO4溶液,X、Y为石墨电极.接通电路后,发现Z上的d点显红色.下列说法正确的是( )
如图,Z为浸透饱和食盐水和酚酞试液的滤纸,水槽中盛有足量CuSO4溶液,X、Y为石墨电极.接通电路后,发现Z上的d点显红色.下列说法正确的是( )| A、接通电路后,水槽中溶液的pH不变 |
| B、b是正极,Y电极上发生氧化反应 |
| C、同温同压下,X、Y两电极上产生气体的体积相等 |
| D、d点显红色是因为接通电路后OH-向d点移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的化学平衡常数不变 |
| B、化学平衡向逆反应方向移动 |
| C、容器中气体压强不变 |
| D、CaO的质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com