
下列变化一定为放热的化学反应的是
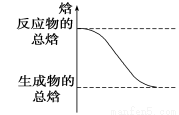
A.H2O(g)===H2O(l)放出44 kJ热量
B.ΔH>0的化学反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如上图所示的化学反应
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由下图判断下列关系错误的是
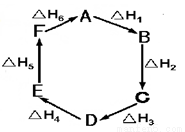
A.A→F,△H = - △H 6
B.△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1
C.C→F,|△H| = |△H 1+△H 2+△H 6 |
D.△H 1+△H 2+△H 3 = -△H 4-△H5-△H 6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
下列物质所含有的原子个数为阿伏加德罗常数的是
A.1mol Cl2 B.0.5mol CO2 C.1 mol氖气 D.0.5mol SO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l)若实验测得反应放出的热量为3695 kJ。则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:填空题
(13分)有A、B、C、D、E五种元素,其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
请回答下列问题:
(1)写出元素E的基态原子的电子排布式_________________。
(2)CA3分子中C原子的杂化类型是________;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是 ,发生的有关反应的离子方程式为 。
(3)C与A还可形成C2A4、CA5等化合物,二者都能与盐酸反应。则C2A4与盐酸反应的离子方程式为 。CA5还可与水反应产生无色气体,且所得溶液显碱性,则CA5的电子式为 ,与水反应的化学方程式 。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
1mol该离子中含有 个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_________(填序号)。
a.平面正方形 B.正四面体 c.三角锥形 D.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。
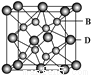
其中D离子的配位数为 ________,该晶体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1。下列说法正确的是

A.第一电离能:Y>Z
B.Y、W的最简单氢化物的水溶液都呈酸性
C.W单质的水溶液具有漂白性
D.W的单质可从Z的简单氢化物种置换出Z的单质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:计算题
(2分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏省高二上学期期中考试化学试卷(解析版) 题型:选择题
[Co(NH3)5Cl]2+配离子,中心离子的配位数是
A.1 B.2 C.4 D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com