
【题目】下列反应既是化合反应,又是氧化还原反应的是( )
A.2CO+O2![]() 2CO2B.CaO+H2O=Ca(OH)2
2CO2B.CaO+H2O=Ca(OH)2
C.C+H2O![]() CO+H2D.CO2+Ca(OH)2=CaCO3↓+H2O
CO+H2D.CO2+Ca(OH)2=CaCO3↓+H2O
科目:高中化学 来源: 题型:
【题目】我国自主研发的“蓝鲸一号”在中国南海神狐海域完成可燃冰连续试采,并得到中共中央国务院公开致电祝贺。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是_______________________________(回答一条即可)。
(2)甲烷自热重整是一种先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+ | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158. 6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。

该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和环境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。

①过程II中第二步反应的化学方程式为_________。
②过程II的催化剂是______,只有过程I投料比![]() _______,催化剂组成才会保持不变。
_______,催化剂组成才会保持不变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是

A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素①X、Y、Z的单质在常温下均为气体;②X单质可以在Z单质中燃烧,生成物为XZ,其中火焰为苍白色;③XZ极易溶于水,电离出X+和Z﹣,其水溶液可使蓝色石蕊试液变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中所得溶液具有漂白作用。
(1)推断元素符号X_____、Y_____、Z_____;
(2)化合物XZ的电子式为_____,X2Y属于_____(填离子化合物、共价化合物、共价分子);
(3)写出XZ(写化学式)的电离方程式_____;写出XZ(写化学式)与Ca(ClO)2反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。

该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:
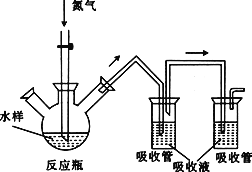
Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。(已知:![]() )
)
回答下列问题:
(1)水浴加热的温度不能高于85℃,原因是_____________________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是_____________________________,若只使用一个吸收管,会导致测定结果偏______________________(填“高”或“低”)。
(4)该200mL水样经吹气、固硫后,滴定操作时共消耗160mLNa2S2O3溶液,则废水中硫的含量为________mg·L-1。
(5)实验室常用FeS固体与酸反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是________(填序号)。

(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的构型判断错误的是
A. 甲烷是正四面体结构,烷烃的碳原子呈直线形
B. 乙烯是平面结构,四个氢原子和二个碳原子共面
C. 苯分子中碳原子采用sp2杂化,得到平面正六边形结构
D. 氨气分子的空间构型为三角锥形,氮原子杂化方式为SP3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850°C时,LiNiO2会分解。请按要求回答下列问题:
(1)LiNiO2中Ni的化合价为___________,工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800°C制得 LiNiO2,该反应的化学方程式为___________,加热温度不宜过高的原因是_________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是_______。
(2)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺如下:

已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①滤渣Ⅱ为___________。
②“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.______________________(用离子方程式表示)。
③转化操作后,还需经过过滤、洗涤、烘干得到产品。检验Ni(OH)2是否洗涤干净的实验操作是___________。
④调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?___________(列式计算,并使用必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。为进一步确定其中Cu2S、CuS的含量,某同学进行了如下实验:
①取2.6g样品,加入200.0mL0.2000mol·L-1酸性KMnO4溶液,加热(硫元素全部转化为SO42-),滤去不溶杂质;
②收集滤液至250mL容量瓶中,定容;
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,消耗20.00mL;
④加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:2Cu2++4I-=2CuI+I2;
⑤加入2滴淀粉溶液,用0.1000mo1·L-1Na2S2O3溶液滴定,消耗30.00mL(已知:2S2O32-+I2=S4O62-+2I-)。
回答下列问题:
(1)写出Cu2S溶于酸性KMnO4溶液的离子方程式:___________;
(2)配制0.1000mol· L-1FeSO4溶液时要用煮沸过的稀硫酸,原因是___________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有___________;
(3)③中取25.00mL待测溶液所用的仪器是___________;
(4)⑤中滴定至终点时的现象为___________;
(5)混合样品中Cu2S和CuS的含量分别为_________%、_________%(结果均保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com