
世界气候大会与2009年在丹麦首都哥本哈根召开,商讨2012年至2020年全球温室气体减排协议。下列物质属于温室气体的是( )
A.可吸入颗粒 B.氮气 C.氧气 D.二氧化碳
科目:高中化学 来源: 题型:
在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2mol NH3,经过一段时间后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为( )
A.25% B.20% C.10% D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是
A.生成物能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g) + Cl2(g) = 2 HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液稀释至10倍后pH=4
C.0.2 mol/L的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
1)稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。
① 实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式 ;
② 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。
则实验测得的中和热△H=____ ___(保留1位小数)
③ 如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”);理由是____________
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO。理论上每消耗标况下22.4 L NO就能放出290 kJ的热。写出该反应的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
最新报道,科学家又发现了某元素的一种原子,它的原子核内有161个中子,质量数为272。该元素的原子序数为 ( )
A.111 B.161 C.272 D.433
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的说法中,错误的是 ( )
A.硫是一种黄色晶体,易溶于水 B.新制氯水应避光保存
C.新制氯水具有漂白作用 D.二氧化氮是红棕色、有刺激性气味的有毒气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60 mL进行实验,测得反应前混合气体中H2所占的体积和反应后气体总体积的关系如图所示(气体体积均在同温同压下测定)。则x的数值为
A.4 B.3 C.2 D.1
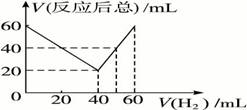
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在红磷存在时,丙酸可与液溴发生取代反应生成了一溴丙酸(CH3CHBrCOOH),写出该反应的方程式______________________________。
(2)结合上述信息,分析下列关系,回答以下问题:
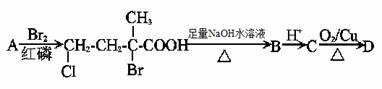
①A的结构简式__________________。
②D中所含官能团的名称___________________。
③C D的方程式为__________________________________________。
D的方程式为__________________________________________。
④D不能发生的反应是___________(填字母序号)
A.水解 B.消去 C.银镜 D.酯化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com