
 近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过同体电解质向Cu极移 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 通空气时,整个反应过程中,铜相当于是催化剂 |
分析 放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为O2+4e-+2H2O=4OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.因为原电池放电时,阳离子移向正极,所以Li+透过固体电解质向Cu极移动,故A正确;
B.该电池通过一种复杂的铜腐蚀而产生电力,由方程式可知铜电极上并非是氧气直接放电,正极反应为Cu2O+H2O+2e-=Cu+2OH-,故B错误;
C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故C正确;
D.由B项分析知:铜先与氧气反应生成Cu2O,放电时Cu2O重新生成Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选B.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中所有原子在同一平面内 | |
| B. | 乙烯分子中含有的官能团是碳碳双键 | |
| C. | 乙烯在一定条件下能与水发生加成反应得到乙醇 | |
| D. | 乙烯能使酸性KMnO4溶液褪色,是因为发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 | |
| B. | 在有AgI沉淀的上层清液中滴加一定浓度的NaCl溶液,不可能产生白色沉淀 | |
| C. | pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+>c(Cl-)>c(OH-)>c(H+) | |
| D. | 室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③④均可与Na、NaOH、H2发生反应,1mol四种物质最多消耗Na、NaOH、H2的物质的量之比依次分别为1:1:1:1、1:2:2:1、4:3:3:5 | |
| B. | ①②③④属同分异构体,分子式为C8H8O3 | |
| C. | 可用银氨溶液或酸性KMnO4溶液区分③④ | |
| D. | ①②③④中所有原子均不可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 含氮有机物对乙酰氨基酚(如图)是生活中常见感冒药的主要成分,下列有关对乙酰氨基酚的说法正确的是( )
含氮有机物对乙酰氨基酚(如图)是生活中常见感冒药的主要成分,下列有关对乙酰氨基酚的说法正确的是( )| A. | 对乙酰氨基酚的分子式为:C8H10NO2 | |
| B. | 对乙酰氨基酚可与浓溴水发生加成反应 | |
| C. | 与对乙酰氨基酚互为同分异构体,分子中含有硝基和苯环,且苯环上有三个取代基的分子共有6种 | |
| D. | 对乙酰氨基酚可以与Na2CO3发生反应,产生CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
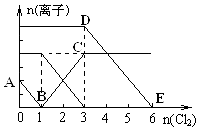 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+ 物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com