
| A. |  称取食盐 | B. |  稀释浓硫酸 | C. |  检查气密性 | D. |  点燃酒精灯 |
分析 A、称量物质,砝码放在右盘;
B、浓硫酸溶于水放出大量的热,稀释浓硫酸应把浓硫酸倒入水中;
C、可以采用微热法检验装置的气密性;
D、不能用燃着的酒精灯点燃另一盏酒精灯.
解答 解:A、称量物质,砝码放在右盘,物质放在左盘,此时称量NaCl,还应在托盘中放2张同样大小的滤纸,故A错误;
B、浓硫酸溶于水放出大量的热,稀释浓硫酸应把浓硫酸倒入水中,以免引起液体迸溅,故B错误;
C、用手温使得试管内气体受热膨胀,导致试管内压强增大,故在烧杯中出现气泡,故此方法正确,故C正确;
D、不能用燃着的酒精灯点燃另一盏酒精灯,以免引起火灾,故D错误,
故选C.
点评 本题主要考查的是实验室常见仪器的使用以及基本操作的正误判断,难度不大,需要平时学习中总结归纳.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
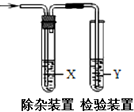 用如图所示装置检验对应气体时,不能达到目的是( )
用如图所示装置检验对应气体时,不能达到目的是( )| 生成的气体 | 试剂X | 试剂Y | |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | Br2的CCl4溶液 |
| B | 木炭与浓H2SO4加热制取的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH乙醇溶液共热制取的乙烯 | 水 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化物碱性强弱:W(OH)2>ZOH | |
| B. | 原子序数:W>Z>X>Y | |
| C. | Y的气态氢化物比X的气态氢化物稳定 | |
| D. | 离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淬火处理后的缝衣钢针制钓鱼钩 | B. | 用食盐水除去热水瓶中的水垢 | ||
| C. | 用电池“锌皮”与食醋反应制氢气 | D. | 用加热的方法修补电木插座 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| B. | 逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都不变,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都减慢,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com