
����Ŀ����.д�����з�Ӧ�缫����ʽ
��1��������Zn|ZnSO4��Һ||CuSO4|Cu��+��,������Ӧ��________
��2��������Pb|H2SO4��Ũ��|PbO2��+�� ������Ӧ��______________
��3��������H2��Pt��|KOH��Һ|��Pt��O2��+�� ������Ӧ��_____________
��.ij��ѧ��ȤС������ͼ��ʾװ�ý��е绯ѧԭ����ʵ��̽�����Իش��������⣺
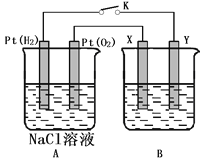
��1��ͨO2��Pt�缫Ϊ���_____________������缫���ƣ�����缫����ʽΪ_____________��
��2����B���Ϊ����ͭ���Ҵ�ͭ�к���Zn��Fe��Ag��Au�����ʣ���õ�����������Ҫ�ɷ���_______��
��3����X��Y����ͭ���������ҺΪNaOH��Һ����ع���һ��ʱ�䣬X����������ש��ɫ�������������ϵ�֪��Cu2O����д���õ缫�����ĵ缫��ӦʽΪ______________��
���𰸡� Zn��2 e��=Zn2+ PbO2+SO42��+2e��+4H+�TPbSO4+2H2O 2H2-4e-+4OH��=4H2O �� O2��4e����2H2O=4OH�� Ag��Au 2Cu��2OH����2e����Cu2O��H2O
�����������⿼�����ԭ��غ͵��صĹ���ԭ�����ص����ҳ�ԭ��ػ���ص�����������������Ӧ���ǻ�ԭ��Ӧ��ͬʱע��������Һ������ԡ�
(1)��п��ͭ��Ϊԭ��ص������缫ʱ��п�Ƚϻ��ã���������ʧȥ��������п���ӣ��缫��ӦΪ Zn��2e��=Zn2+ �� (2) Ǧ�Ͷ�����ǦΪ�����缫�ĵ���У�Ǧʧȥ���ӣ���������������Ǧ���������õ����ӣ������Һ�������������������Ǧ���缫��ӦΪPbO2+SO42��+2e��+4H+�TPbSO4+2H2O����3)�õ��Ϊ����ȼ�ϵ�أ���ҺΪ���ԣ����������ڸ�����Ӧʧȥ���ӽ����������������ˮ���缫��ӦΪ2H2-4e-+4OH��=4H2O��������������Ӧ�������������ӣ���.��1������Ϊ����ȼ�ϵ�أ�ͨ��������һ��Ϊ������ͨ��������һ��Ϊ��������ҺΪ�Ȼ��ƣ����������õ������������������ӣ��缫��ӦΪ��O2��4e����2H2O=4OH������2��BΪ��⾫��ͭ����XΪ�������缫����Ϊ��ͭ��YΪ������Ϊ��ͭ���ڵ������У���ͭ�е�п��ͭ������ʧȥ�����������ӣ������ͽ��ܷ�Ӧ��Ϊ��������֣���3��XΪ������ͭʧȥ���ӣ����������Ϣ��˵����������������ͭ����缫��ӦΪ��2Cu��2OH����2e����Cu2O��H2O��


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯȼ�Ͽ��ɡ��ӹ����̲�����H2S��������ͨ�����ַ�������������������ȡ������ͬʱ�������ʣ��������ֻ������ش��������⣺
(1)��֪��2H2(g)+O2(g)=2H2O(g) ��H1
S(s)+ O2(g)=SO2(g) ��H2
2S(s)![]() S2(g) ��H3
S2(g) ��H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) ��H4
��Ӧ2H2S(g)![]() 2H2(g)+ S2(g)�ġ�H=_____
2H2(g)+ S2(g)�ġ�H=_____
(2)��ҵ�ϲ��ݸ����ȷֽ�HzS�ķ�����ȡH2����Ĥ��Ӧ���з����H2��
�ں����ܱ������У���H2S����ʼŨ�Ⱦ�Ϊ0.009 mol/L���Ʋ�ͬ�¶Ƚ���H2S�ֽ⣺![]() ��ʵ������в��H2S��ת������ͼ��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶�F��Ӧ������ͬʱ��ʱH2S��ת���ʡ�
��ʵ������в��H2S��ת������ͼ��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶�F��Ӧ������ͬʱ��ʱH2S��ת���ʡ�

����935��ʱ���÷�Ӧ����t s H2S��ת���ʴﵽP����ֵ������ts����H2Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)=________��
���¶����ߣ�ƽ����____�����ƶ��������Ӧ�����淴Ӧ������ƽ�ⳣ��____���������С�����䡱����985��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ________��
������H2S�ֽ��¶ȵ����ߣ�����b��������a��������ԭ����___________��
(3)��ⷨ��������������FeCl3��Һ���պ�H2S�Ĺ�ҵ������������Һ�ö��Ե缫��⣬������������Һѭ�����á�

�ٽ�����ص���Һ�У�������____��
�������ĵ缫��ӦʽΪ________________��
�۵���ܷ�Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H �Ǻϳɿ���ҩ��������ƵĹؼ��м��壬����һ�ֺϳ�·������:
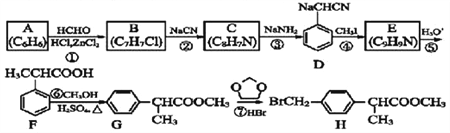
�ش���������:
(1)�����Ǽ��A������ͼ�У�����ʺɱȵ���ֵ��________��G�й�����������__________��
(2)B�Ľṹ��ʽΪ_________________________��
(3)��Ӧ�ڵķ�Ӧ����Ϊ_________________________����Ӧ�ܵĻ�ѧ����ʽΪ____________��
(4)д����������������F��ͬ���칹��Ľṹ��ʽ:________________________��
I.����FeCl3��Һ������ɫ��Ӧ
II.�ܷ���������Ӧ
III.�˴Ź���������4����ҷ����֮��Ϊ6:2:1:1
(5)����H �ĺϳ�·�ߣ����һ����![]() �ĺϳ�·��______��
�ĺϳ�·��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ͼʾ�ĸ�װ�õ���������ȷ����



A. װ�ü��ǿ����������϶�ͭ��װ��
B. װ������Ϊ��⾫��ͭװ�ã���X�缫Ϊ��ͭ
C. װ�ñ���a�˲�����������ʹʪ��ĵ��۵⻯����ֽ����
D. װ�ö������ڲⶨ��ѧ��Ӧ�ķ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڹ�ũҵ����������Ҫ����;���Ȼ�ͭ���Ȼ�ҵͭ������������������CuCl�㷺Ӧ���ڻ�����ӡȾ����ҵ��
���������ϡ�(i)�Ȼ�ͭ����ˮ��Һ�нᾧʱ����15�����µõ���ˮ���15-25.7��õ���ˮ���26~42��õ���ˮ���42�����ϵõ�һˮ���100�õ���ˮ�
(ii)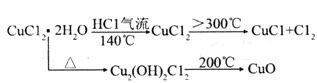
(1)ʵ��������ͼ��ʾ��ʵ��������ҩƷ�Ʊ��������������������ͭ��Ӧ(����̨��������)�Ʊ��Ȼ�ͭ��

�ٰ������������Ӹ������ӿ�˳����:
a��_____��_____��_____��_____��_____��_____��_____��
�ڱ���װ��������������Ҫ���ȣ����ȵ�˳��Ϊ��_____��_______
(2)ӡˢ��·�����ɸ߷��Ӳ��Ϻ�ͭ�����϶��ɣ�����ӡˢ��·ʱ��Ҫ��FeCl3��Һ��Ϊ����ʴҺ����д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
(3)������(2)������Һ��ô�����CuCl22H2O���������²�����
����������Һ�м���H2O2��ҺȻ���ټ��Լ�X���ڵ���pH�����ˣ���ȥ���ʣ�X��ѡ�������Լ��е�(�����)
a.NaOH b.NH3H2O C.CuO d.CuSO4
��Ҫ��ô���CuCl22H2O�����ϵ�в�������Ϊ�����������Һ�м��������ᣬ����Ũ����_____��_____��ϴ�ӡ����
(4)��CuCl22H2OΪԭ���Ʊ�CuClʱ���������к���������CuCl2��CuO���ʣ���������CuCl2���������ԭ����______________��
(5)��Ƽ�ʵ����֤0.1mol/L��CuCl2��Һ�е�Cu2+��H2O2�ķֽ���д�����:_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������˵����ȷ���� �� ��
����ÿһ��ˮ�����ں����������
�£�����ˮ��ˮ�����ж��������
C��DNA�еļ�����������ͨ�������ʵ�ֵ�
D��H2O��һ�ַdz��ȶ��Ļ�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ͽṹ��ͼ������һ���������ܷ����ķ�Ӧ�У��������� �ټӳɷ�Ӧ
��ˮ�ⷴӦ
����ȥ��Ӧ
��ȡ����Ӧ
����NaHCO3��Ӧ�ų�CO2
�Ӿ۷�Ӧ��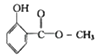
A.�٢ڢ�
B.�٢ڢ�
C.�ܢݢ�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�CH3COOH��NH3��H2O�ĵ��볣����Ϊ1.8��10��5����20 mLŨ�Ⱦ�Ϊ0.1 mol/L NaOH��NH3��H2O�Ļ��Һ�еμӵ����ʵ���Ũ�ȵ�CH3COOH��Һ�����û��Һ�ĵ����������CH3COOH��Һ�������V���Ĺ�ϵ��ͼ��ʾ������˵������ȷ����

A. a=20��b=40������Һ�����Դ���A��B����֮��
B. B����Һ�У�c(CH3COO��)��c(Na��)��c(NH![]() ��
��
C. ��֪lg3��0.5����C���pH��5
D. A��B��C�����У�B����Һ��ˮ�ĵ���̶����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com