
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物分子式的常用装置。
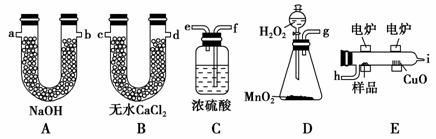
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是________________________________________________________________;
(2)C装置中浓硫酸的作用是__________________________________________
______________________________;
(3)D装置中MnO2的作用是__________________________________________
_____________________________;
(4)燃烧管中CuO的作用是___________________________________________
____________________________;
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的实验式为________;
(6)要确定该有机物的分子式,还要知道______________________________
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH 0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率_ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A. Fe(NO3)3加入过量的HI溶液:2Fe3++2I-== 2Fe2++I2
B. 硫酸镁溶液与氢氧化钡溶液混合:SO42- + Ba2+== BaSO4↓
C. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:
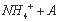 1
1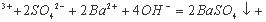 Al(OH)3↓+NH3•H2O
Al(OH)3↓+NH3•H2O
D.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:
Ba2++OH-+H++SO2- 4==BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性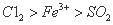 ,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
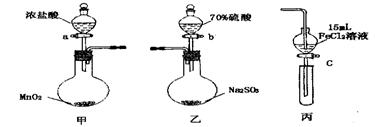
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_______ _____。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______ _______。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
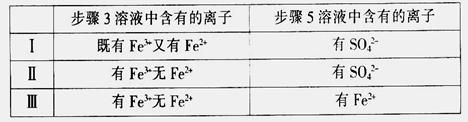
上述实验结果一定能够证明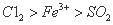 的是______(填“I”、“II”或“III”)。
的是______(填“I”、“II”或“III”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++ 2e-===Pb2++2H2O | 阳极:2Al+3H2O- 6e-===Al2O3+6H+ |
| D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两个反应所属反应类型相同的是
( )
A.光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色
B.乙烷在氧气中燃烧;乙烯在氧气中燃烧
C.乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色
D.工业上由乙烯和水反应生成乙醇;乙烯能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述乙炔的结构和性质中,既不同于乙烯,也不同于乙烷的是
( )
A.存在不饱和键
B.不易发生取代反应,易发生加成反应
C.分子中的所有原子都处在同一条直线上
D.能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式改写为化学方程式,正确的是( )
A.Ag++Cl-===AgCl↓
AgNO3+NaCl===AgCl↓+NaNO3
B.Cu+2Ag+===Cu2++2Ag
Cu+2AgCl===CuCl2+2Ag
C.Ba2++SO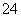 ===BaSO4↓
===BaSO4↓
Ba(OH)2+H2SO4===BaSO4↓+2H2O
D.CO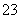 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
NaHCO3+HCl===NaCl+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com