���𰸡�
������BԪ��ԭ�ӵ��������������ڲ��������2����ӦΪCԪ�أ�CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y����CΪNԪ�أ���Ӧ����Ϊ����泥�A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij��������DӦΪOԪ�أ�AΪHԪ�أ�EΪNaԪ�أ����γɶ��������
��1��������ˮ�ĵ��룬��ˮ��ٽ�ˮ�ĵ��룻
��2��A��B��D��E����Ԫ����ɵ�ij������������ֽ⣬ΪNaHCO
3����Ϸ�Ӧ������ʵ�����д���ӷ���ʽ��
��3��A��B��D��E����Ԫ����ɵ�ij��������ΪNaHCO
3��ˮ��������ԣ�
��4���ٸ������ʵ����ı仯��֮�ȵ��ڻ�ѧ������֮���жϣ�
�ڼ����ƽ��ʱ�����ʵ�Ũ�ȣ����ƽ�ⳣ������ʽ���㣻
�ۼ���˲������ʵ�Ũ����֮������ƽ�ⳣ����Ƚϣ��������ж�ƽ���ƶ�����
�ܸ���0.4molҺ̬N
2H
4�ų�256.65kJ������������1molN
2H
4��Ӧ�ų�������������д����Ӧ���Ȼ�ѧ����ʽ��
����⣺BԪ��ԭ�ӵ��������������ڲ��������2����ӦΪCԪ�أ�CԪ�ص�����������ˮ����X�����⻯�ﷴӦ����һ����Y����CΪNԪ�أ���Ӧ����Ϊ����泥�A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij��������DӦΪOԪ�أ�AΪHԪ�أ�EΪNaԪ�أ���
��1��XΪHNO
3������ˮ�ĵ��룬pH=5ʱ����ˮ���������c��H
+��=10
-9mol/L��YΪNH
4NO
3��ˮ��ٽ�ˮ�ĵ��룬pH=5ʱ����ˮ���������c��H
+��=10
-5mol/L��������ˮ��Һ����ˮ�������H
+Ũ��֮����10
-4��1���ʴ�Ϊ��10
-4��1��
��2��A��B��D��E����Ԫ����ɵ�ij������������ֽ⣬ΪNaHCO
3�������û�������Һ��������Ba��OH��
2��Һ��Ӧ����BaCO
3��H
2O����Ӧ�����ӷ���ʽΪBa
2++HCO
3-+OH
-�TBaCO
3��+H
2O���ʴ�Ϊ��Ba
2++HCO
3-+OH
-�TBaCO
3��+H
2O��
��3��A��B��D��E����Ԫ����ɵ�ij��������ΪNaHCO
3��ˮ��������ԣ�ѡ����ֻ��C���ϣ��ʴ�Ϊ��C��
��4����A����N
2��Ӧ0.1molʱ��H
2��Ӧ0.3mol������NH
30.2mol������ת����ϵ����A��ȷ��
B��NH
3��Ӧ1mol��Ӧ����H
21.5mol����ƽ��״̬��ͬ����B����
C����N
2��Ӧ0.1molʱ��H
2��Ӧ0.3mol������NH
30.2mol������ԭ��NH
30.2mol��ƽ��ʱNH
3ӦΪ0.4mol����ƽ��״̬��ͬ����C����
�ʴ�Ϊ��B��C��
��k�T
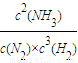
=
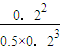
=10���ʴ�Ϊ��10��
����������¶Ⱥ�ѹǿ���䣬������ƽ����ϵ�м���0.18molN
2��
ԭƽ����ϵ�У�1.0L�����к��з���0.5mol+0.2mol+0.2mol=0.9mol��
������N
2����ϵ˲���з���0.9mol+0.18ml=1.08mol��˲�������Ϊ1.08×
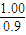
=1.2L��
���ԣ�Q=
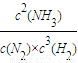
=
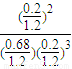
=10.59��10��ƽ�������ƶ���
�ʴ�Ϊ������ԭƽ����ϵ�У�1.0L�����к��з���0.5mol+0.2mol+0.2mol=0.9mol��������N
2����ϵ˲���з���0.9mol+0.18ml=1.08mol��˲�������Ϊ1.08×
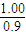
=1.2L�����ԣ�Q=
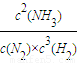
=
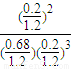
=10.59��10��ƽ�������ƶ���
��1molN
2H
4��Ӧ�ų�������Ϊ
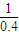
×256.65kJ=641.63kJ��
��Ӧ���Ȼ�ѧ����ʽΪN
2H
4��l��+2H
2O
2��l��=N
2��g��+4H
2O��g����H=-641.63kJ?mol
-1��
�ʴ�Ϊ��N
2H
4��l��+2H
2O
2��l��=N
2��g��+4H
2O��g����H=-641.63kJ?mol
-1���������⿼��ԭ�ӽṹ��Ԫ��������֪ʶ����Ŀ�ѶȽϴ����ڻ�ѧƽ���Լ���Ӧ�ȵļ��㣬����ʱע�����ƽ�ⳣ���ļ��㼰Ӧ�ã�

 2CA3��g��
2CA3��g��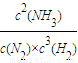 =
=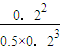 =10���ʴ�Ϊ��10��
=10���ʴ�Ϊ��10��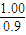 =1.2L��
=1.2L��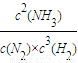 =
=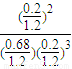 =10.59��10��ƽ�������ƶ���
=10.59��10��ƽ�������ƶ���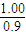 =1.2L�����ԣ�Q=
=1.2L�����ԣ�Q=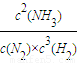 =
=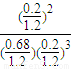 =10.59��10��ƽ�������ƶ���
=10.59��10��ƽ�������ƶ���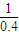 ×256.65kJ=641.63kJ��
×256.65kJ=641.63kJ��












 Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������
Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������