
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
分析 由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,
A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为:碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;
(1)根据碳酸钠能够发生水解分析;
(2)根据硫酸铝和过量的氢氧化钡反应,硫酸铝全部反应,铝离子和硫酸根之间按照物质的量之比是2:3进行反应;
(3)根据盐酸抑制水的电离以及硫酸铝促进水的电离,利用水的离子积常数计算出水电离出的氢离子浓度来比较;
(4)根据碳酸钠与等物质的量的盐酸等物质的量反应生成等物质的量碳酸氢钠和氯化钠,以及碳酸氢钠要发生电离和水解来分析.
解答 解:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,
A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为:碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;
(1)碳酸根水解产生氢氧根使溶液呈碱性:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)硫酸铝和过量的氢氧化钡反应,按照物质的量之比是1:4,方程式为Al2(SO4)3+4Ba(OH)2═Ba(AlO2)2+3BaSO4↓+4H2O,
离子方程式为:2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓,
故答案为:2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓;
(3)盐酸溶液的pH=4,则C(H+)=10-4 mol/L,则C(OH-)=$\frac{10{\;}^{-14}}{10{\;}^{-4}}$=10-10 mol/L,OH-完全是由水电离产生,所以水电离出的氢离子浓度=10-10 mol/L;硫酸铝在溶液中水水解使水显示酸性,溶液中的氢离子浓度就是水电离出的氢离子浓度,PH=4,则C(H+)=10-4 mol/L,所以硫酸铝溶液中水电离出的氢离子浓度是盐酸溶液中水电离出的氢离子浓度的106倍,
故答案为:106;
(4)盐酸溶液逐滴加入等体积、等物质的量的浓度的碳酸钠溶液中,HCl与碳酸钠反应生成等物质的量的NaHCO3和NaCl,碳酸氢根离子的水解大于电离,溶液显碱性,所以离子浓度为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+).
点评 本题考查知识点较多,根据离子的共存、离子的性质来推断物质是解答本题的关键,综合性强,难度较大,学生需熟悉水解、热化学反应方程式、离子反应等知识来解答.


科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:推断题
下列各种物质中,除B、D两种物质外,其余各物质均由短周期元素组成。已知常温常压下A为无色无味液体,B、C、G属于金属单质,化合物F的焰色反应为黄色火焰,常温下0.1mol/L的F溶液pH=13,D为黑色有磁性的氧化物。上述物质之间存在如图1所示的转化关系(略去部分反应条件)。
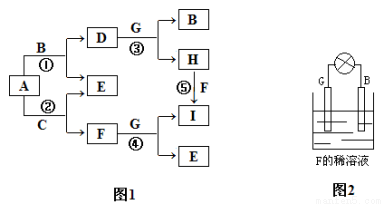
回答下列问题:
(1)写出F的电子式 ;
(2)组成G的元素在周期表中的位置是 ;
(3)写出反应①的化学方程式: ;
(4)写出反应⑤的离子方程式: ;
(5)由B、G、F溶液组成如图2所示的装置,其中G上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
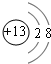
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li+、Na+、Al3+、K+ | B. | F2、Cl2、Br2、I2 | C. | F-、Cl-、Br-、I- | D. | Li、Na、K、Rb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com