
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50mL18mol•L-1浓硫酸与足量铜供热,转移电子数为0.9NA | |
| C. | 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA | |
| D. | 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA |
分析 A.H218O与D2O的摩尔质量均为20g/mol,且两者中均 含10个中子;
B.铜只能与浓硫酸反应,与稀硫酸不反应;
C.FeBr2溶液中离子还原性Fe2+>Br-,氯气先和亚铁离子反应,再与溴离子反应,结合反应定量关系计算判断;
D.标准状况下,2.24LNO物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,和足量氧气反应生成0.1molNO2,且存在2NO2?N2O4.
解答 解:A.H218O与D2O的摩尔质量均为20g/mol,故20gH218O与D2O的物质的量均为1mol,且两者中均 含10个中子,故1molH218O与D2O中均含10NA个中子,故A正确;
B.铜只能与浓硫酸反应,与稀硫酸不反应,故浓硫酸变稀后反应即停止,即硫酸不能反应完全,则转移的电子数小于0.9NA个,故B错误;
C..FeBr2溶液中离子还原性Fe2+>Br-,0.1molFeBr2溶液中Fe2+物质的量为0.1mol,Br-离子物质的量为0.2mol,
Cl2+2Fe2+=2Fe3++2Cl-,
1 2
0.05mol 0.1mol
剩余氯气0.05mol和溴离子反应,
2Br-+Cl2=Br2+2Cl-,
2 1
0.1mol 0.05mol
被氧化的溴离子为0.1mol,故C错误;
D.标准状况下,2.24LNO物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,和足量氧气反应生成0.1molNO2,2NO2?N2O4,反应生成物中含有NO2分子数小于0.1NA ,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C为易错点,注意认真审题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 洒在桌面上的酒精燃烧,立即用湿抹布盖灭 | |
| D. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
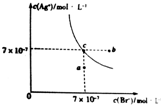 已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )
已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )| A. | t℃时,图中a点到c点所示溶液变化状态可加入AgBr固体 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液状态由c点到b点 | |
| C. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K=28.6 | |
| D. | 在t℃时,向含Br-、Cl-的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$为1.225×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
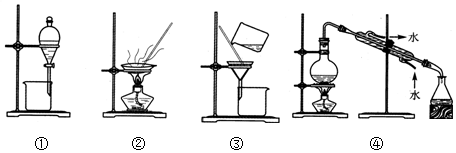
| A. | 装置①用于分离苯和水 | |
| B. | 装置②用于分离乙醇中的水 | |
| C. | 装置③用于分离FeCl3和Fe(SCN)3 | |
| D. | 装置④用于分离氯化钠和氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 除去Na2CO3固体中的NaHCO3 | 用酒精灯灼烧固体混合物 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸与浓盐酸在空气中敞口放置时浓度均减小 | |
| B. | 金属导电与电解质溶液导电 | |
| C. | 在净水过程中分别使用明矾和漂白粉 | |
| D. | 工业上制取金属铁和金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
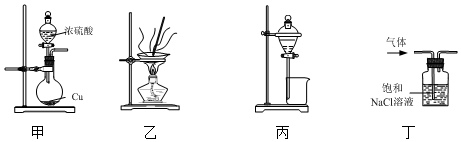
| A. | 用装置甲制取少量SO2 | |
| B. | 用装置乙蒸发FeCl3溶液制取FeCl3晶体 | |
| C. | 用装置丙分离CH3COOH和CH3COOCH2CH3的混合液 | |
| D. | 用装置丁除去Cl2中混有的少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: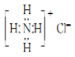 | |
| B. | 四氯化碳分子球棍模型: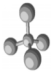 | |
| C. | 丙烯醛的结构简式:CH3CH2COH | |
| D. | 碳酸氢根离子的水解方程式:HCO3-+H2O?CO32-+H3O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 11.2 g Fe在高温下与足量水蒸气反应,生成的H2分子数目为0.3×6.02×1023 | |
| D. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出的氢气多,说明酸性HB>HA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com