




 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:不详 题型:填空题
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | Z的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱金属单质在空气中燃烧的生成物都是过氧化物 |
| B.少量的碱金属单质都能保存在煤油中 |
| C.HF、HCl、HBr、HI的稳定性、还原性从左到右依次减弱 |
| D.随着原子序数的递增,卤素单质的颜色由浅到深,熔沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X>Y>Z |
| B.X>Z>Y |
| C.Y>X>Z |
| D.Y>Z>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18O2与16O2性质完全相同 | B.N4=2N2是化学变化 |
| C.N4和N2互为同位素 | D.18O2中含18个中子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
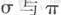 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。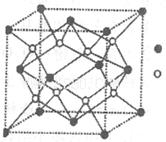
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | I1 | I2 | I3 | I4 | …… |
| R | 740 | 1 500 | 7 700 | 10 500 | …… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com