
甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在,丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2015-2016学年江西省、高安二中高二上期中联考化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+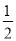 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
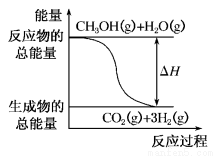
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+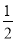 O2(g)===CO2(g)+2H2(g) ΔH >-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH >-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上第二次段考化学试卷(解析版) 题型:选择题
某高聚物结构简式为: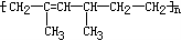 ,其单体的名称为
,其单体的名称为
A.2,4 -二甲基-2-己烯
B.2,4-二甲基-1,3-己二烯
C.2-甲基-1,3-丁二烯和丙烯
D.2-甲基-1, 3-戊二烯和乙烯
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:填空题
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续地生产。请回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)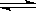 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则NH3催化氧化生成NO和H2O(g)的热化学反应方程式可表示为: 。
(2)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
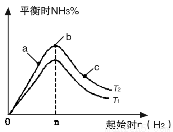
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是 。
②在起始时体系中加入N2的物质的量为1mol。若容器容积
为2L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
③图像中T1和T2的关系是:T1 T2。(填“>”“<”“=”“无法确定”)
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):
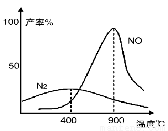
4NH3+5O2 4NO+6H2O ;
4NO+6H2O ;
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)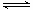 4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率可表示为____________________。
②下列情况能说明该反应已达平衡状态的是 。
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:选择题
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:选择题
一定温度下,反应2SO2 + O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3) = 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3) = 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
硼及其化合物在现代工业、生活和国防中有着重要的应用价值。

(1)基态硼原子的电子排布式是 ;最简单的硼烷是B2H6(乙硼烷),结构如右图所示,其中B原子的杂化方式为 ;
(2)三氯化硼和三氟化硼常温下都是气体,都有强烈的接受孤电子对的倾向。推测它们固态时的晶体类型为 ;三氟化硼与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键 ;
(3)经结构研究证明,硼酸晶体中B(OH)3单元结构如图Ⅰ所示。各单元中的氧原子通过O﹣H…O氢键连结成层状结构,其片层结构及键长、层间距数据如图Ⅱ所示。层与层之间以微弱的分子间力相结合构成整个硼酸晶体。
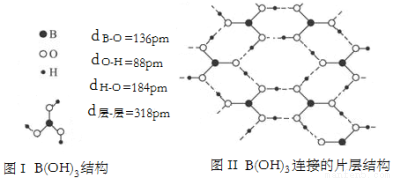
①H3BO3是一元弱酸,写出它与水反应的化学方程式 ;
②根据结构判断下列说法正确的是 ;
a.硼酸晶体有滑腻感,可作润滑剂 b.H3BO3分子的稳定性与氢键有关
c.含1mol H3BO3的晶体中有3mol氢键 d.H3BO3分子中硼原子最外层为8e-稳定结构
(4)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,右图为其晶胞结构示意图。
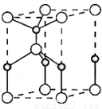
①该功能陶瓷的化学式为 ;
②第一电离能介于B、N之间的第二周期元素有 种。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中考试化学试卷(解析版) 题型:填空题
用下面的原子或离子结构示意图的编号(A、B、C、D)填空:
A.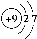 B.
B.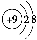 C.
C. D.
D.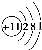
(1)电子层排布相同的是________________;
(2)属于同种元素的是__________________;
(3)属于金属元素的是____________;其离子的结构示意图___________。
(4)属于稀有气体元素的是________,稀有气体一般不参加化学反应的原因是_____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com