
【题目】有一种生产碘的方法是用亚硫酸氢钠还原碘酸盐(IO3-),每还原出1mol碘分子,理论上需用去亚硫酸氢钠( )
A. 1mol B. 2mol C. 2.5mol D. 5mol
科目:高中化学 来源: 题型:
【题目】己知:①Cl2+2Fe2+=2Cl-+2Fe3+ ②2Fe3++2I-=2Fe2++I2;判断下列物质的还原性从强到弱的顺序是
A. Cl-> Fe2+> I- B. I-> Fe2+> Cl- C. Fe2+> Cl-> I- D. I-> Cl-> Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一些原子的电子排布,其中不是激发态原子的是( )
A. 1s22s22p6B. 1s22s13s1C. 1s22s24d1 D. 1s22s22p23s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-=2RO4n-+3Cl-+5H2O,则RO4n-中R的化合价是
A. +3 B. +4 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
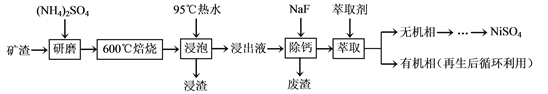
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
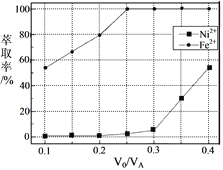
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是
(CH3)2C==O+HCN→ (CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4→CH2== C(CH3)COOCH3+NH4HSO4,
90年代新的反应是:CH3C≡CH+CO+CH3OH![]() CH2==C(CH3)COOCH3,与旧法比较,新法的优点是:①原料无爆炸危险 ;②原料都是无毒物质;③没有副产物,原料利用率高;④对设备腐蚀性较小。正确的是
CH2==C(CH3)COOCH3,与旧法比较,新法的优点是:①原料无爆炸危险 ;②原料都是无毒物质;③没有副产物,原料利用率高;④对设备腐蚀性较小。正确的是
A. ①② B. ③④ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. Na2CO3==2Na++CO32- B. Ba(OH)2==Ba2++OH-
C. H2SO4== H22++SO42- D. KNO3==K++N5++3O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com