
| A. | Ca(ClO)2 | B. | CI2 | C. | CaCl2 | D. | Ca(OH)2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 点燃可燃性气体前必须验纯 | |
| C. | 气体实验装置在实验前要进行气密性检查 | |
| D. | 滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

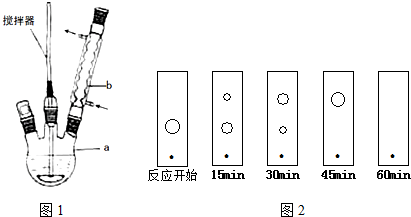
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
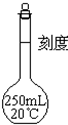 配制250mL 1mol/LNaOH溶液.回答下列问题:
配制250mL 1mol/LNaOH溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 | |
| C. | 电解精炼铜,粗铜中所含Ni、Fe,Zn等杂质,电解后以单质形式沉积槽底 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
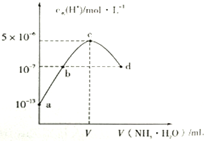 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| C. | NH3.H2O的电离常数K=10-4 | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com