



| ||
| ||
| O2 |
| O2 |
| H2O |
| 高温 |
| H2O |
| O2 |
| O2 |
| H2O |
| 高温 |
| H2O |
 ;
; ;CH≡CH;
;CH≡CH;
| ||
| ||
| O2 |
| O2 |
| H2O |


科目:高中化学 来源: 题型:
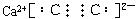
(1)写出B的电子式___________,D的结构简式___________。
(2)写出A与B反应的化学方程式____________________________________。
(3)将I气体通入溶有饱和C气体的NaCl溶液,是侯氏制碱法的一步关键反应,该反应的化学方程式为___________________________________。
(4)写出下列反应的离子方程式:
①在A溶液中加入M_________________________________。
②向A溶液中加入过量NaOH溶液,并加热________________________。
③已知Fe3O4能溶于M溶液并产生F气体,该离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
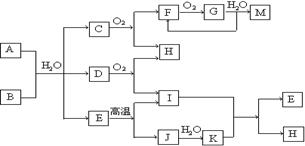
(1)写出B的电子式 ,D的结构简式 ________。
(2)写出A与B反应的化学方程式 。
(3)如对气体G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
① 在A溶液中加入M ;
② 向A溶液中加入过量NaOH溶液,并加热 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【12分】已知A为酸式盐,B为某二价主族金属元素的化合物,C、D、F、G、I在常温常压下均呈气态,且D燃烧时产生的氧炔焰常用来焊接或切割金属。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。

(1)写出B的电子式___________,D的结构简式___________。
(2)写出A与B反应的化学方程式____________________________________。
(3)将I气体通入溶有饱和C气体的NaCl溶液,是侯氏制碱法的一步关键反应,该反应的化学方程式为___________________________________。
(4)写出下列反应的离子方程式:
①在A溶液中加入M_________________________________。
②向A溶液中加入过量NaOH溶液,并加热________________________。
③已知Fe3O4能溶于M溶液并产生F气体,该离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省金华一中高三上学期期中考试化学试卷 题型:填空题
(10分)已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。请回答下列问题:
(1)写出B的电子式 ,
(2)写出A与B反应的化学方程式 。
(3)如对气体 G进行加压操作,产生的现象是 。
G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
①在A溶液中加入M 。
②向A溶液中加入过量NaOH 溶液,并加热 。
溶液,并加热 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com