
【题目】S-诱抗素可保证盆栽鲜花盛开,其分子结构如图,下列说法不正确的是

A. 该物质的分子式为C15H20O4 B. 该物质环上的二氯代物只有2种
C. 1mol该物质最多能与2 mol NaOH完全反应 D. 该物质能发生取代、加成、氧化等反应
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是

A. 过氧化钠 B. 氧化钠
C. 钠 D. 钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为______,价层电子排布式为________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4 的熔、沸点较低的原因为________。
②写出一种与CO 互为等电子体的分子的化学式________。
③Ni(CO)4中 σ 键和 π 键的数目之比为________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为________,该离子中杂化轨道的作用是________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
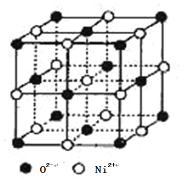
①镍离子的配位数为________。
②天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为Ni0.97O(相对分子质量为73), 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为________;若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为________pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式如下: 分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c。则a、b、c分别为
分子中处于四面体中心位置的碳原子数为a,一定在同一直线上的碳原子个数为b,一定在同一平面上的碳原子数为c。则a、b、c分别为
A. 4、4、7 B. 4、3、6 C. 3、5、4 D. 2、6、4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2 ![]() HCOONa+H2O下列有关说法正确的是( )
HCOONa+H2O下列有关说法正确的是( )
A. 储氢、释氢过程均无能量变化
B. 释氢过程中,每消耗0.1molH2O放出2.24L的H2
C. 上述储氢原理和钢瓶储氢原理相同
D. 1mol固体NaHCO3 中含有2NA个离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。

(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的强酸性溶液中,能大量共存的一组离子是
A. Mg2+、A13+、SO42-、NO3- B. Na+、HCO3-、K+、SO42-
C. MnO4-、K+、SO42-、Na+ D. NH4+、Fe2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1LFeBr2溶液中,通入1.12L(标态下)的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是
A. 原溶液的浓度为0.1mol/L B. 反应后溶液中c(Fe3+)=0.1mol/L
C. 反应后溶液中c(Fe3+)=c(Fe2+) D. 原溶液中c(Br-)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性.
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2==2ClO2+_____。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,写出化学方程式:_____________
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2== S4O62-+2I-)
Ⅲ加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_____。
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/L的Na2S2O3溶液10ml,则水样中ClO2的浓度是_____ mg/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com