

| ||
| △ |
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、0.3mol |
| B、0.45mol |
| C、0.6mol |
| D、0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,饱和KCl溶液的浓度大于4.0mol/L | ||
B、此溶液中KCl的质量分数为74.5×
| ||
| C、20℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液 | ||
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g/cm3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al与冷的浓H2SO4:2Al+12H++3SO42-═2Al3++3SO2+6H2O |
| B、氨水与盐酸反应:H++OH-═H2O |
| C、Fe与FeCl3溶液:Fe+Fe3+═2Fe2+ |
| D、少量Al Cl3溶液滴入NaOH溶液中:Al3++4OH-═「Al(OH)4」- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯是1825年由俄国科学家门捷列夫发现的 |
| B、苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 |
| C、苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 |
| D、苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
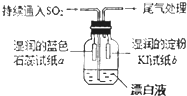 SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题:
SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com