
| A. | 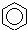 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$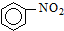 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |
分析 有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,
断开不饱和双键或三键生成饱和单键的反应属于加成反应,
加氧或去氢的有机反应为氧化反应,据此解答即可.
解答 解:A、苯环上的氢原子被硝基取代生成硝基苯,属于取代反应,故A正确;
B、甲烷中的氢原子被氯原子取代生成CH3Cl,属于取代反应,故B错误;
C、乙烯与氯化氢生成一氯乙烷,不饱和双键变成饱和单键,属于加成反应,故C正确;
D、乙醇与氧气催化氧化生成乙醛属于氧化反应,故D正确,
故选B.
点评 本题考查有机化学反应类型,明确有机物中的官能团及性质的关系,熟悉常见有机物的性质及反应即可解答,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 红葡萄酒密封储存时间越长,质量越好,原因之一是贮存过程中生成了有香味的酯 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )| A. | 固体F中含有配位键 | B. | D和E分子间均可形成氢键 | ||
| C. | A、B、C三种分子均属于非极性分子 | D. | E分子中中心原子的杂化类型为sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体甲可能为纯净物 | |
| B. | 该溶液中一定存在NH4+、Al3+、NO2-、SO42- | |
| C. | 该溶液中一定不存在Na+、Mg2+、HCO3-、Cl- | |
| D. | 无法确定Na+、HCO3-、NO2-是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2CH2CH2OH | B. | 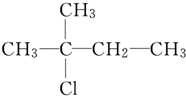 | ||
| C. | 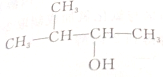 | D. | 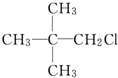 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
 ,
, G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com