
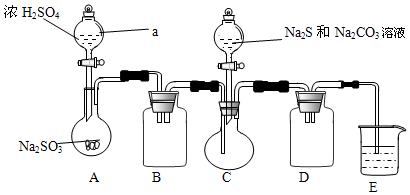
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
分析 I.(1)根据仪器构造和作用可知;E装置目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠溶液反应,与稀H2SO4和饱和NaHSO3溶液不反应;
(2)A装置由亚硫酸钠和浓硫酸制备二氧化硫气体;
II.(4)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl;硝酸、硫酸、盐酸等性质比较可知;
(5)根据亚硫酸钠易被氧化生成硫酸钠分析;
(6)依据反应的定量关系 2S2O32-~I2,计算碘单质消耗的硫代硫酸钠,计算得到样品的纯度.
解答 解:Ⅰ.(1)仪器a为分液漏斗,使用前要检漏,方法为:关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水;E装置的氢氧化钠溶液吸收SO2,防止污染空气;
故答案为:分液漏斗;关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水;吸收SO2,防止污染空气;
(2)A装置由亚硫酸钠和浓硫酸制备二氧化硫气体,反应为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
II.(4)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4;
故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl;沉淀部分溶解,并有刺激性气味的气体产生;
(5)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
故答案为:先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液;
(6)根据反应的方程式可知,I2~2Na2S2O3,样品中Na2S2O3•5H2O的物质的量是cmol/L×V×10-3L×2,
所以在产品中的质量分数为$\frac{cmol/L×V×1{0}^{-3}L×2×248g/mol}{m}×100%$=$\frac{49.6cV}{m}$%,
故答案为:$\frac{49.6cV}{m}$.
点评 本题考查了物质性质的实验验证和实验方法应用,物质性质的掌握和实验基本操作是解题关键,题目难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该烃的分子式为C7H8 | |
| B. | 该烃的含碳量大于乙烯的含碳量 | |
| C. | 该烃一氯代物有5种 | |
| D. | 该烃在光照或催化剂作用下能和氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量 | |
| B. | 含有食品添加剂的食物对人体均有害 | |
| C. | 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用 | |
| D. | 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
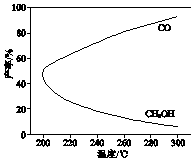 在一定条件下,利用CO2合成CH3OH的反应如下:
在一定条件下,利用CO2合成CH3OH的反应如下:| A. | △H1<0,△H2>0 | |
| B. | 增大压强有利于加快合成反应的速率 | |
| C. | 生产过程中,温度越高越有利于提高CH3OH的产率 | |
| D. | 合成CH3OH反应的平衡常数表达式是K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
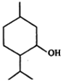
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com