
 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.分析 (1)利用三段法计算平衡时的浓度来计算化学平衡常数,可逆反应NO2(g)+SO2(g)?SO3(g)+NO(g)△H>0.设加入的二氧化氮的物质的量为a,则二氧化硫的为2a,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的量 1a 2a 0 0
转化物质的量 x x x x
平衡物质的量 a-x 2a-x x x
则(a-x):(2a-x)=1:6,
x=$\frac{4a}{5}$
平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,依据计算得到的平衡状态下物质的浓度计算平衡常数;
(2)①根据氮气浓度计算参加反应的一氧化氮浓度,再根据转化率公式计算NO的转化率,根据v(NO)=$\frac{△c}{△t}$计算;
②若改变反应条件,导致CO浓度减小,可以采用改变温度或容器容积的方法;
(3)①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1
②2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1;
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1
将方程式①-②+2③得到;
(4)①NH3•H2O?NH4++OH-,K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;
②结合平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:(1)可逆反应NO2(g)+SO2(g)?SO3(g)+NO(g)△H>0.设加入的二氧化氮的物质的量为a,则二氧化硫的为2a,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的量 1a 2a 0 0
转化物质的量 x x x x
平衡物质的量 a-x 2a-x x x
则(a-x):(2a-x)=1:6,
x=$\frac{4a}{5}$,
则平衡时,C( NO2)=$\frac{a-x}{V}$mol/L=$\frac{a}{5V}$,
C(SO2)=$\frac{2a-x}{V}$=$\frac{6a}{5V}$
C(SO3)=C(NO)=$\frac{4a}{5V}$,
平衡常数K=$\frac{\frac{4a}{5V}×\frac{4a}{5V}}{\frac{a}{5V}×\frac{6a}{5V}}$=$\frac{8}{3}$,
故答案为:$\frac{8}{3}$;
(2)①0~15min△C(N2)=0.2mol/L,同一可逆反应中,各物质浓度变化之比等于其计量数之比,所以△C(NO)=2△C(N2)=0.4mol/L,NO的转化率=$\frac{\frac{0.4mol/L}{2.0mol}}{2L}$×100%=40%,
故答案为:40%;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但平衡时CO浓度大于第一次平衡浓度,故错误;
b.增加CO的量,平衡向正反应方向移动,但CO的转化率减小,所以CO的浓度增大,故错误;
c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度小于第一次平衡浓度,故正确;
故选c d,
故答案为:c d;
(3)①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1
②2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1;
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1
将方程式①-②+2③得4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=(-a+b-2c )kJ•mol-1,
故答案为:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H=(-a+b-2c )kJ•mol-1;
(4)①已知NH3•H2O的Kb=2.0×10-5,0.10mol/L的 NH3•H2O溶液中电离平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,
c(OH-)=$\sqrt{Kb×0.10mol/L}$=$\sqrt{2×1{0}^{-6}}$mol/L=1.4×10-3mol/L,
故答案为:1.4×10-3;
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20mol/L,K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,
c(OH-)=$\frac{K×c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{2×1{0}^{-5}×0.1}{0.2}$mol/L=10-5mol/L,
故答案为:10-5.
点评 本题考查了化学平衡的有关计算以及盖斯定律的应用,根据反应速率、转化率公式计算NO的反应速率、转化率,利用平衡移动原理分析平衡移动、化学平衡常数的计算,明确化学反应达到平衡状态的浓度计算是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中都有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 取两小块铝箔,将其中一片打磨,灼烧均能看到铝箔熔化但不滴落的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
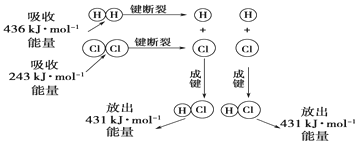
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
| C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
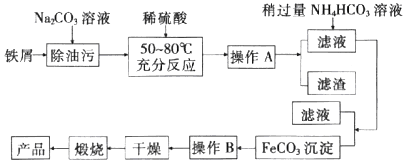
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 不移动 | |
| D. | 可能向正反应方向移动,也可能向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 题号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| 1 | 丙烷(丙烯) | ||
| 2 | CH3CH2OH (CH3COOH) | ||
| 3 | 苯(溴) | ||
| 4 | 乙烯(SO2、CO2) | ||
| 5 | CO2(SO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com