
| A. | 13 | B. | 15 | C. | 14 | D. | 不能确定 |
分析 根据电荷守恒:c(Cl-)+c(OH-)=c(Na+)+c(H+),溶液c(Cl-)=c(Na+),则c(OH-)=c(H+),溶液呈中性,则HCl与NaOH恰好完全反应.
解答 解:根据电荷守恒:c(Cl-)+c(OH-)=c(Na+)+c(H+),溶液c(Cl-)=c(Na+),则c(OH-)=c(H+),溶液呈中性,则HCl与NaOH恰好完全反应,故V×10-3L×10-amol/L=10V×10-3L×$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L,整理可得:a+b=13,
故选:A.
点评 本题考查pH有关计算,难度不大,注意pH=a的强酸与pH=b的强碱混合呈中性时满足:$\frac{{V}_{酸}}{{V}_{碱}}$=10a+b-14.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe2++Fe3++4H2O | |
| C. | 硅酸钠与二氧化碳的反应:SiO32-+CO2(少量)+H2O═HCO3-+H2SiO3↓ | |
| D. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少氮氧化物的排放 | B. | 降低对臭氧层的破坏 | ||
| C. | 减少二氧化碳的排放 | D. | 防止温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫化亚铁与稀硝酸反应制H2S气体FeS+2H+═Fe2++H2S↑ | |
| B. | 标准状况下将1.12 L氯气通入10 mL 1 mol•L-1的溴化亚铁溶液中2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| C. | 向碳酸氢钠溶液中加入过量的澄清石灰水Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素的化合价为+2 | |
| B. | NaCN易与水反应,发生大爆炸,造成多名消防队员牺牲 | |
| C. | 可用强氧化剂如H2O2等将NaCN氧化为无毒物质 | |
| D. | 为防止中毒,须加强对地表水、排海口等的氰化物排查 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al2O3 $\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{20}}{→}$Ag(NH3)2OH(aq)$→_{△}^{蔗糖}$Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
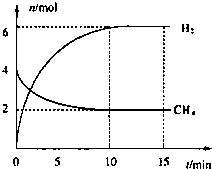 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com