
【题目】下列各组元素中,原子半径依次增大的是( )
A.Li、Na、KB.I、Br、FC.O、Al、SD.Li、F、Cl
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验方案所得到的现象,得出的结论一定正确的是
甲中玻璃管盛放的物质 | 乙中现象 | 结论 | |
A | 还原铁粉、用水湿润的玻璃纤维 | 肥皂水中有气泡 | 水蒸气高温下与铁反应生成了氢气 |
B | CaCO3 、SiO2 | 石灰水变浑浊 | CaCO3 和 SiO2 高温下反应生成了 CO2 |
C | 碎瓷片、石蜡油(主要成分为烷烃) | 酸性 KMnO4 溶液褪色 | 石蜡油可能发生了分解反应 |
D | FeCl3 固体(熔点 306℃、沸点 315℃)、MnO2 固体 | 淀粉 KI 溶液变蓝 | 加热时 MnO2 能将 FeCl3 氧化成 Cl2 |
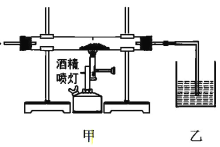
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C13H18O2)具有香味,可用作香皂、洗发香波的芳香剂。
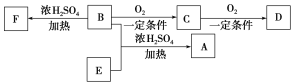
已知:①B属于芳香族化合物,分子式为C8H10O;
②D、E具有相同的官能团,E分子烃基上只有一种氢原子;
③F可以使溴的四氯化碳溶液褪色。
回答下列问题:
(1)B→F的反应类型是________,F的结构简式为____________。
(2)C、D分子所含的官能团的名称依次是________________、________________。
(3)E的同分异构体有多种,写出一种符合下列条件的有机物的结构简式:_______。
a.有两种含氧官能团;b.核磁共振氢谱显示有4个峰;c.能发生银镜反应,能与金属钠反应,但不能与氢氧化钠溶液反应。
(4)B和E反应生成A的化学方程式为____________________________________。
(5)D可以发生的反应有________(填序号)。
①酯化反应 ②消去反应
③加成反应 ④氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________;CO2中所含共价键的类型_____________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。_______________。
(3)SO2 与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________________,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+H2SO4,该反应中,氧化产物是______;若反应中转移了0.04mol的电子,有________g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。
为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为__________(杂质不参与反应)。(保留至0.1%)
(6)“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。请写出金属钒与浓硝酸反应的离子方程式:_______________________________________。
(7)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的
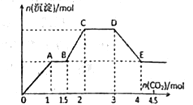
A. CD段的离子方程式可以表示为:CO32-+CO2+H2O═2HCO3-
B. 肯定不存在的离子是SO42-、OH-
C. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
D. OA段反应的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___[Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是_____________
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________(用化学式表示),其理由为_______________。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________, RZ2的密度___________g/cm3(用a、b表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com