
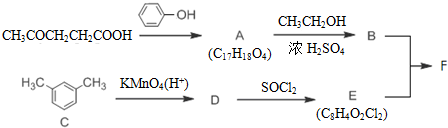
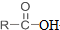 +SOCl2→
+SOCl2→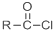 +SO2+HCl
+SO2+HCl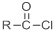 +R′OH→
+R′OH→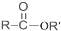 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)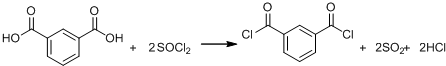 .
.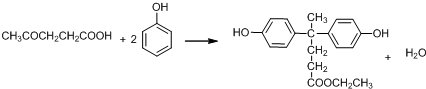 .
.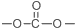 结构.
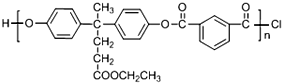
结构. 分析 根据各物质的转化关系,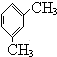 被酸性高锰酸钾氧化生成D为
被酸性高锰酸钾氧化生成D为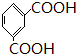 ,D中羧基上的羟基被氯原子取代生成E为
,D中羧基上的羟基被氯原子取代生成E为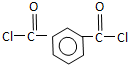 ,由聚芳酯F的结构可知B为
,由聚芳酯F的结构可知B为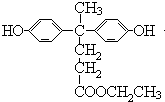 ,逆推可知A为
,逆推可知A为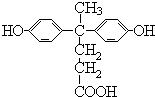 ,据此答题.
,据此答题.
解答 解: 被酸性高锰酸钾氧化生成D为
被酸性高锰酸钾氧化生成D为 ,D中羧基上的羟基被氯原子取代生成E为
,D中羧基上的羟基被氯原子取代生成E为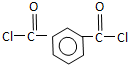 ,由聚芳酯F的结构可知B为
,由聚芳酯F的结构可知B为 ,逆推可知A为
,逆推可知A为 .
.
(1)乙酰丙酸中含有的官能团是羧基、羰基,故答案为:羧基、羰基;
(2)C的结构简式为 ,系统命名为:1,3-二甲基苯,故答案为:1,3-二甲基苯;
,系统命名为:1,3-二甲基苯,故答案为:1,3-二甲基苯;
(3)B的结构简式为 ,
,
a.含有酚羟基、酯基等,均与氢氧化钠发生反应,1molB最多能与3molNaOH反应,故a错误;
b.含有酚羟基,且其邻位有H原子,能与浓溴水反应,1molB最多能与4molBr2发生取代反应,故b错误;
c.不能能发生消去反应,故c正确;
d.含有苯环,能与H2发生加成反应,故d正确,
故选:cd;
(4)B、E合成聚酯F的反应类型为:缩聚反应,D生成E的化学反应方程式: ,
,
故答案为:缩聚反应; ;
;
(5)乙酰丙酸生成A的化学反应方程式为: ,
,
故答案为: ;
;
(6)C8H6O4符合下列条件的D( )的同分异构体:①能发生银镜反应,含有醛基,②能与NaHCO3溶液反应,含有羧基,③分子中有苯环,分子中无
)的同分异构体:①能发生银镜反应,含有醛基,②能与NaHCO3溶液反应,含有羧基,③分子中有苯环,分子中无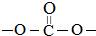 结构,侧链为-OOCH、-COOH,有邻、间、对3种,侧链为-OH、-CHO、-COOH,当-OH、-CHO处于邻位时,-COOH有4种位置,当-OH、-CHO处于间位时,-COOH有4种位置,当-OH、-CHO处于对位时,-COOH有2种位置,故共有3+4+4+2=13种,
结构,侧链为-OOCH、-COOH,有邻、间、对3种,侧链为-OH、-CHO、-COOH,当-OH、-CHO处于邻位时,-COOH有4种位置,当-OH、-CHO处于间位时,-COOH有4种位置,当-OH、-CHO处于对位时,-COOH有2种位置,故共有3+4+4+2=13种,
故答案为:13.
点评 本题考查有机物推断与合成、有机物的结构与性质、同分异构体书写等,侧重考查学生分析推理能力,注意根据反应条件及物质的结构采取正、逆推法相结合推断,题目难度中等.


科目:高中化学 来源: 题型:解答题
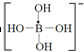 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
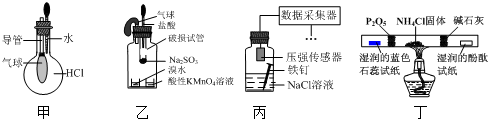
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

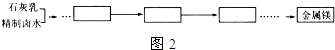
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
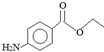
| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
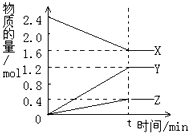 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com