
| A. | 空气中电子式为${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量过多会造成温室效应 | |
| B. | 结构示意图为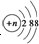 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的两种化合物均为常见的氧化剂 |
分析 A.二氧化碳分子中含有两个碳氧双键,不是单键;
B.当n=16时为硫离子,硫离子能够促进水的电离;
C. 为比例模型,不是球棍模型;
为比例模型,不是球棍模型;
D.Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H分别为过氧化钠、氧气的电子式.
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故A错误;
,故A错误;
B.结构示意图为 的阴离子可能为硫离子,硫离子结合水电离的氢离子,能够促进水的电离,故B错误;
的阴离子可能为硫离子,硫离子结合水电离的氢离子,能够促进水的电离,故B错误;
C. 为乙烯的比例模型,乙烯的球棍模型为:
为乙烯的比例模型,乙烯的球棍模型为: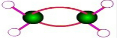 ,故C错误;
,故C错误;
D.Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+为过氧化钠,H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H为氧气,二者都具有强氧化性,为常见的氧化剂,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及球棍模型与比例模型、离子结构示意图、电子式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有强腐蚀性 | |
| B. | 能用于氯气、二氧化硫的干燥 | |
| C. | 可贮存在铁制容器中 | |
| D. | 可在盛有浓硫酸的烧杯中加水稀释成稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L盐酸 | B. | pH=11氨水 | ||
| C. | pH=4NaHSO3溶液 | D. | 0.01mol/L Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
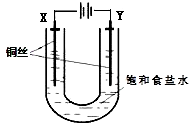 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O═CaSO4↓+2H++Cl-+HClO | |
| C. | 用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 在碳酸氢钙溶液中加入过量的氢氧化钙溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
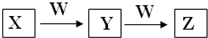 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系:
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答:
A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答: ;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.
;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com