
下列实验可实现鉴别目的的是( )
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
答案 C
解析 SO3和SO2均是酸性氧化物,都能与KOH溶液发生反应生成相应的含氧酸盐:SO3+2KOH===K2SO4+H2O,SO2+2KOH===K2SO3+H2O,且都无明显现象,不能实现鉴别目的,A项不正确;Br2(g)和NO2都具有较强的氧化性,都能将I-氧化为I2而使湿润的碘化钾淀粉试纸变蓝,不能实现鉴别目的,B项不正确;NaAlO2溶液中通入少量CO2发生反应:2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO3,有白色沉淀生成,CH3COONa溶液中通入CO2不发生反应,无明显现象,可实现鉴别目的,C项正确;BaCl2溶液与AgNO3溶液可发生反应:Cl-+Ag+===AgCl↓,产生白色沉淀,BaCl2溶液与K2SO4溶液可发生反应:Ba2++SO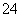 ===BaSO4↓,也产生白色沉淀,不能实现鉴别目的,D项不正确。
===BaSO4↓,也产生白色沉淀,不能实现鉴别目的,D项不正确。


科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应的水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对各组离子或物质是否能够大量共存解释正确的是(双选)( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能 |
| 共存 | NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 | |
| B | c(OH-)=1.0×10-13 mol·L-1溶液中,Fe2+、NO | 不能 |
| 共存 | 发生反应:3Fe2++NO | |
| C | 溶液中:K+、Cu2+、Cl-、NH3·H2O | 不能 |
| 共存 | 发生反应:Cu2++2NH3·H2O===Cu(OH)2↓+2NH | |
| D | 溶液中:Al3+、Na+、SO | 可以 |
| 共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常见非金属元素及化合物的特征性质和应用
(1)C、N、O、Si、S、Cl等元素形成的单质中:
①属于空气主要成分的是__________,它们相互反应的化学方程式
________________________________________________________________________;
②常用于自来水消毒的是________,它与NaOH溶液反应的离子方程式
________________________________,实验室制备该气体的化学方程式
________________________________________________________________________;
③属于半导体材料的是__________,其工业制取方法是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
| 选项 | 事实 | 结论 |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 可用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | 氧化铜高温下生成红色物质,该物质可与稀硫酸反应 | 氧化铜高温下可分解生成Cu2O |
| D | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。
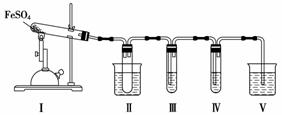
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是__________________________,试管浸泡在50 ℃的水中,其目的是____________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液、0.5 mol·L-1 BaCl2溶液、0.5 mol·L-1 Ba(NO3)2溶液、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有______________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有____________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是__________。
(4)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄。
①甲同学推测该反应的还原产物有两种可能:a.Cl2、b:Cl-。
乙同学结合甲同学的推测,认为其中一种可能可以排除,你认为可以排除的是哪种可能,并用简要的文字和离子方程式说明理由:________________。
②上述反应的离子方程式为__________________。
③为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:__________(填序号)。
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g);△H=-QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g);△H=-QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
I II III
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图II研究的是t0时刻加入催化剂后对反应速率的影响
C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应:H2(g)+Br2(g) 2HBr(g) ΔH<0,达到平衡后,欲使颜色加深,应采取的措施是( )。 A.升高温度 B.降低温度 C.增大H2浓度 D.减小压强
2HBr(g) ΔH<0,达到平衡后,欲使颜色加深,应采取的措施是( )。 A.升高温度 B.降低温度 C.增大H2浓度 D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物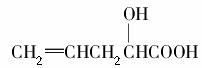 在不同条件下至少可能发生7种不同类型的反应:
在不同条件下至少可能发生7种不同类型的反应:
①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于分子结构中含有“—OH”而可能发生的反应是( )。
A.②④⑥⑦ B.①③⑤⑥
C.②③④⑤ D.①③④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com