
| A. | 核外电子排布完全相同的两种微粒的化学性质一定相同 | |
| B. | 单原子形成的离子一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两种粒子一定属于同种元素 | |
| D. | 不存在质子数和电子数分别相同的阳离子和阴离子 |
分析 A、核外电子排布完全相同的两种微粒不一定属于同种元素,化学性质不一定相同;
B、副族元素的单原子形成的离子不一定具有稀有气体原子的核外电子排布;
C、离子的质子数不等于核外电子数;
D、不存在两种质子数和电子数均相同的阳离子和阴离子.
解答 解:A、核外电子排布完全相同的两种微粒不一定属于同种元素,化学性质不一定相同,如Na+与F-核外电子排布相同,但是二者化学性质不同,故A错误;
B、副族元素的单原子形成的离子不一定具有稀有气体原子的核外电子排布,如成Fe2+的核外电子排布式为1s22s22p63s23p63d6,不具有稀有气体原子的核外电子排布,故B错误;
C、核外电子排布完全相同的两种微粒不一定属于同种元素,如Na+与F-,故C错误;
D、阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数,所以不存在两种质子数和电子数均相同的阳离子和阴离子,故D正确;
故选D.
点评 本题考查了原子结构和性质,根据原子结构采用反例法分析解答,注意规律中的异常现象,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 16mo1 | B. | 19 mol | C. | 20mol | D. | 23mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,将待过滤的物质沿玻璃棒倒入过滤器时,玻璃棒下端应靠在三层滤纸处 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,温度计应插入在溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素的氢化物中只有极性键没有非极性键 | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 三种元素的气态最简单氢化物中Z的氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 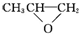 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物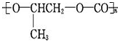 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 | |
| B. | 正丁烷的二氯代物有5种(不考虑立体异构) | |
| C. | 乙醇在铜催化下加热可脱氢生成乙醛,该反应属于氧化反应 | |
| D. | 淀粉、纤维素、麦芽糖均属于糖类,在一定条件下都可以水解得到葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com