
| A. | CuO | B. | H2SO4 | C. | CuSO4 | D. | Al |
科目:高中化学 来源: 题型:选择题
| A. | 催化转化器中的铂催化剂可加快CO的氧化 | |
| B. | 铂表面做成蜂窝状更有利于提高催化效果 | |
| C. | 在铂催化下,NO、NO2可被CO还原成N2 | |
| D. | 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
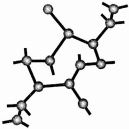 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
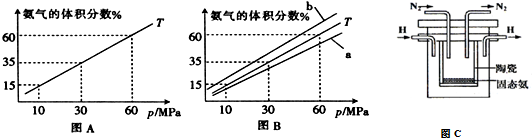
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
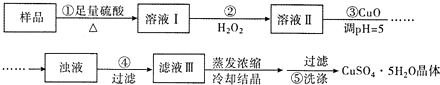
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最外层电子数:Y>W | D. | Y、z的氧化物都是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com