
向含有NaBr 、KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是 ( )
A.NaCl 和KI B.NaCl、KCl和I2 C.KCl和NaBr D.KCl和NaCl
科目:高中化学 来源: 题型:
A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示。
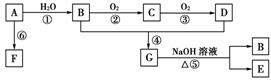
(1)A分子的电子式是________;D中官能团名称是________。
(2)在反应①~⑥中,属于加成反应的是________;属于取代反应的是________(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法
________________________________________________________________________
________________________________________________________________________(填一种即可)
用于鉴别B、D和甲的一种试剂是________。
(4)写出下列反应的化学方程式:
G―→B+E:___________________________________________________;
A―→F:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向少量FeCl3溶液中滴入KSCN溶液,发生反应:FeCl3+3KSCN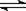 Fe(SCN)3+3KCl。欲使试管内溶液红色变浅,下列措施合理的是
Fe(SCN)3+3KCl。欲使试管内溶液红色变浅,下列措施合理的是
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体
A.②③ B.②④ C.①② D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.H2O分子和NH3分子具有相同数目的质子总数 B. 18O和O2-是两种不同的核素
C.H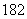 O和H
O和H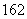 O属于同素异形体 D. 14C和14N互为同位素
O属于同素异形体 D. 14C和14N互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德常数,下列说法中,正确的是 ( )
A.1 L 0.5 mol·L-1Ca(NO3)2 溶液中含有的 NO 数目为0.5NA
数目为0.5NA
B.5.6g Fe粉在足量的Cl2中完全燃烧转移的电子数目为0.2NA
C.在常温常压下,11.2 L氮气所含的原子数目为NA
D.17 g氨气所含电子数目为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的表述正确的是( )
A.离子结构示意图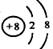 :可以表示16O2-,也可以表示18O2-
:可以表示16O2-,也可以表示18O2-
B.比例模型  :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
C.氯化铵的电子式为: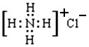
D.CO2的结构式为: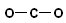
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
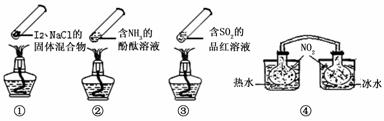
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性。回答下列问题:
| A | B | |
| C | D |
(1)A的氢化物的电子式是 。
(2)下列叙述中,正确的是 (填字母)。
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2->D2-
c.酸性:H4CO4>H2DO4 d.最高化合价:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。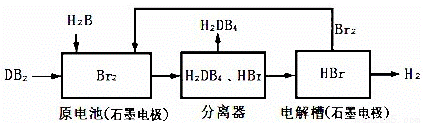
①根据资料:
| 化学式 | Ag2SO4 | AgBr | AgCl |
| Ksp | 1.4×10-5 | 5.0×10-13 | 1.8×10-10 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好。
②在原电池中,负极发生的反应式为 。
③在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”)。
④将该工艺流程用总反应的化学方程式表示为: ;该生产工艺的优点有 (答一点即可)。
⑤某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
查阅有关资料知:金属铝与氢氧化钠溶液反应实际是分以下两步进行:
第一步:2Al+6H2O===2Al(OH)3+3H2↑
第二步:Al(OH)3+NaOH===Na[Al(OH)4]
试回答下列问题:
(1)书写金属铝与氢氧化钠溶液反应的离子方程式:____________________________。
(2)判断两步反应的反应类型:第一步属________,第二步属________(用四种基本反应类型答题)。
(3)请分析,金属铝与氢氧化钠溶液的反应中氧化剂是________,还原剂是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com