
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
科目:高中化学 来源: 题型:
【题目】某小组对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.出现浑浊,溶液变为黄绿色; ⅱ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是______________________。
(3)甲同学认为现象i中溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是___________________。
(4)乙同学通过实验确定了A瓶中大量白色沉淀是CaSO4,并用离子方程式解释了现象ⅱ中黄绿色褪去的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG 定义为 AG= lg![]() ,若用 AG 来表示溶液的酸度,说法不正确的是
,若用 AG 来表示溶液的酸度,说法不正确的是
A.在一定温度下,溶液的酸性越强,AG 越大
B.65℃时,pH 与 AG 的换算公式为 AG = 2 (7 – pH)
C.若溶液显碱性,则 AG < 0
D.若溶液显中性,则 AG = 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃在碱性条件下可以发生如下水解反应:(R 代表烃基)R—X+NaOH![]() R—OH+NaBr。A、B、C、D、E、F、G、H 八种有机化合物有如下转换关系,部分化合物的分子式已给出。
R—OH+NaBr。A、B、C、D、E、F、G、H 八种有机化合物有如下转换关系,部分化合物的分子式已给出。
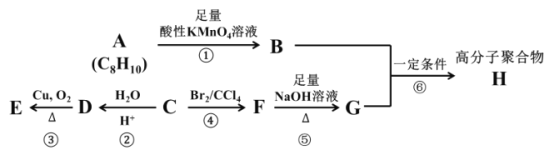
其中,某烃 C 是重要的石油化工产品,其产量可以用来衡量一个国家的石油化工发展水平。化合物 A 属于芳香烃,且苯环上的所有氢原子等效(处于相同的化学环境)。高分子聚合物 H 是工业上重要的聚酯纤维,被大量用于制作矿泉水瓶和衣物纤维。请根据上述信息,回答下列问题:
(1)化合物 A 的结构简式为 _______,A 的二氯代物有____种,A 的分子中最多可能有____个原子共平面。
(2)反应②的反应类型是 _____,化合物 D 中官能团的名称为 ______。
(3)请写出反应③的化学反应方程式______。
(4)请写出反应⑥的化学反应方程式______,并指出该反应的反应类型:_____。
(5)二取代芳香族化合物 I 是化合物 B 的同分异构体,且满足下列条件:
①能发生银镜反应;②不能与NaHCO3 溶液反应生成CO2;③苯环上只含有一种取代基
试写出 I 的任意两种可能的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:

①则25℃时水的电离平衡曲线应为_____。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____。
(3)下列说法中正确的是_____。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答
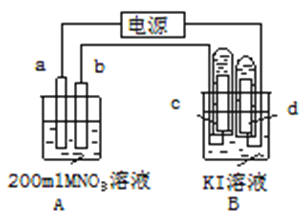
(1)a连接电源的__________极。b极的电极反应式为______________________________。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:_______________,电解进行一段时间后,罩在C极上的试管中也收集到了气体。此时C极上的电极反应式为________________________________
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了__________mol气体,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
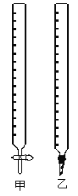
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法原理:NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl,下列相关化学用语正确的是
A.中子数为8的氮原子:![]()
B.氧原子的结构示意图: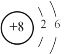
C.NaHCO3的电离方程式:NaHCO3=Na++H++![]()
D.CO2的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是氧化性酸,其本质是NO![]() 有氧化性,某课外实验小组进行了下列有关NO
有氧化性,某课外实验小组进行了下列有关NO![]() 氧化性的探究(实验均在通风橱中完成)。
氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
⑴写出铜与稀硝酸反应的离子方程式_____。
⑵实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_____。
⑶实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是______。
查阅资料:活泼金属与1mol·L-1稀硝酸反应有H2和NH![]() 生成,NH
生成,NH![]() 生成的原理是产生H2的过程中NO
生成的原理是产生H2的过程中NO![]() 被还原。
被还原。
⑷用如图装置进行实验Ⅲ:溶液X为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH![]() 。生成NH
。生成NH![]() 的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
⑸进一步探究碱性条件下NO![]() 的氧化性,进行实验Ⅳ(如图):
的氧化性,进行实验Ⅳ(如图):
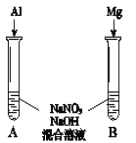
①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_____。
②A中生成NH3的离子方程式是______。
⑹将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com