
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 用足量的氨水吸收硫酸工业尾气中的SO2:SO2+NH3•H2O=NH4++HSO3- |
分析 A.次氯酸根离子具有氧化性能够氧化氨气生成氮气;
B.泡沫灭火器原料为硫酸铝与碳酸氢钠,二者发生双水解生成氢氧化铝和二氧化碳;
C.“84消毒液”的成分为NaClO,发生氧化还原反应生成氯气;
D.氨水足量反应生成亚硫酸铵.
解答 解:A.加入NaClO将污水中的NH3氧化成N2,离子方程式::3ClO-+2NH3=N2↑+3Cl-+3H2O,故A正确;
B.泡沫灭火器的灭火原理,离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故B错误;
C.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体的离子反应为ClO-+Cl-+2H+=Cl2↑+H2O,故C错误;
D.用足量的氨水吸收硫酸工业尾气中的SO2,离子方程式:SO2+2NH3•H2O=2NH4++SO32-+2H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意泡沫灭火器原理,题目难度不大.


科目:高中化学 来源: 题型:解答题
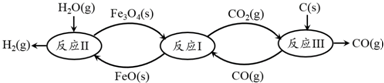
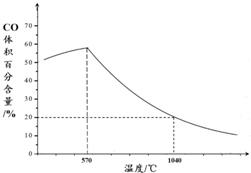

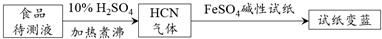
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2 min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4 min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,到达平衡时n(CO2)<0.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将某钾盐固体溶于盐酸 | 产生无色无味的气体 | 该钾盐是K2CO3 |
| B | 向可能含有Fe2+的Fe2(SO4)3溶液中加入酸性KMnO4溶液 | KMnO4溶液褪色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 向浓度均为0.1 mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 | |
| D. | 微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| D. | 处理废水时,加入明矾作为消毒剂除去水中的细菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 | 现象和结论 |
| A | 实验室制较纯净乙烯 | 将浓硫酸、乙醇混合液加热至170℃,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色,说明除去了SO2,得到纯净乙烯气体 |
| B | 检验淀粉的水解程度 | 向混合溶液中直接加入银氨溶液,加热 | 没有出现银镜,说明淀粉还没有水解 |
| C | 验证甲烷与氯气发生取代反应 | 将过量的氯气与甲烷混合,光照一段时间后滴入硝酸银溶液 | 有白色沉淀产生,证明发生取代反应 |
| D | 比较碳酸与醋酸的酸性强弱 | 用pH计测定0.1mol•L-1的碳酸氢钠和醋酸钠的pH值 | 碳酸氢钠溶液的pH大,证明碳酸的酸性比醋酸弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此盐酸溶液与蒸馏水等体积混合后,所得溶质的质量分数小于$\frac{ω}{2}$ | |
| B. | 此盐酸溶液与蒸馏水等质量混合后,所得溶液的物质的量浓度小于$\frac{c}{2}$ mol/L | |
| C. | c=$\frac{1000Vd}{36.5V+22400}$ | |
| D. | ω=$\frac{36.5V}{36.5V+22400}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com