

 ,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变红棕色.分析 在强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,强酸性溶液中就一定不含NO3-离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,与硝酸反应生成I为NH4NO3,沉淀G为Fe(OH)3,溶于盐酸生成J为FeCl3,溶液H中通入过量CO2气体,生成沉淀K,则K为Al(OH)3,L为NaAlO2,说明溶液中含有Al3+离子,不能确定是否含有的离子Fe3+,检验用硫氰化钾溶液,以此解答该题.
解答 解:在强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,强酸性溶液中就一定不含NO3-离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,与硝酸反应生成I为NH4NO3,沉淀G为Fe(OH)3,溶于盐酸生成J为FeCl3,溶液H中通入过量CO2气体,生成沉淀K,则K为Al(OH)3,L为NaAlO2,说明溶液中含有Al3+离子,不能确定是否含有的离子Fe3+,检验用硫氰化钾溶液,
(1)二价铁离子具有还原性,硝酸具有氧化性,二价铁离子被硝酸氧化生成三价铁离子,硝酸被还原成一氧化氮,方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)溶液B中加入过量NaOH溶液,生成气体F,NH4++OH-=NH3↑+H2O,氨气的电子式: ,实验中,可以观察到反应②的现象是无色一氧化氮变为红棕色二氧化氮气体,
,实验中,可以观察到反应②的现象是无色一氧化氮变为红棕色二氧化氮气体,
故答案为: ;气体由无色变红棕色;
;气体由无色变红棕色;
(3)I为NH4NO3,检验铵根离子,可取适量溶液与试管中,加入浓氢氧化钠溶液后加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+,
故答案为:取适量溶液与试管中,加入浓氢氧化钠溶液后加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+;
(4)沉淀G为Fe(OH)3,NaAlO2溶液中通入过量二氧化碳生成偏铝酸钠和碳酸氢钠,反应的离子方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:Fe(OH)3;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(5)由以上分析可知一定不会存在Ba2+、CO32-、SiO32-、NO3-;含有SO42-、Al3+、Fe2+、NH4+,不能确定是否含有的离子Fe3+,检验用硫氰化钾溶液,取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之无 Fe3+;
故答案为:Ba2+、CO32-、SiO32-、NO3-;④.
点评 本题考查离子检验、无机物推断,为高频考点和常见题型,侧重于学生的分析能力和实验能力的考查,关键是根据实验现象判断存在的离子,需要学生熟练中元素化合物知识,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间内消耗a molA,同时生成2a mol C | |
| C. | A的浓度不再变化 | |
| D. | 混合气体总物质的量为2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
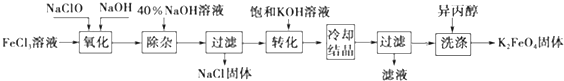
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
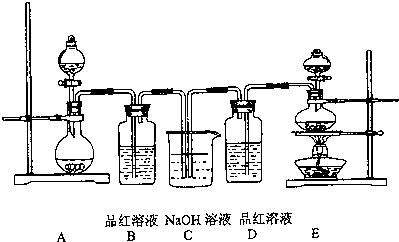
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为3.0g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | \ |
| ⑥摇匀、装瓶、贴上标签 | \ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同位素:1H、D+、T2 | |
| B. | 电解质:CaCO3、CH3COOH、NH4HCO3 | |
| C. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 | |
| D. | 硅酸盐产品:晶体硅、水泥、陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
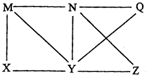 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )| A. | X可能为Al或Cl2 | B. | Y一定为NaOH(aq) | ||
| C. | N一定是HCl(aq) | D. | Q、Z中的一种必定为Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com