
| A. | 蔗糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 纤维素 |
科目:高中化学 来源: 题型:选择题
| 内容 | 结论 | |
| A | 一个反应的△H>0,△S>0 | 反应一定不能自发进行 |
| B | 硝酸铵溶于水可自发进行 | 因为该反应的△S>0 |
| C | H2O(g)变成H2O(l) | △S<0 |
| D | H2(g)+F2(g)═2HF(g)的△H=-271kJ•mol-1,△S=+8J•mol-1•K-1 | 反应在任意温度下都能自发进行 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
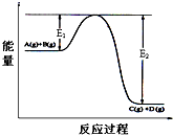
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和浓硝酸反应制硝酸铜 | |
| B. | 用铜作催化剂将乙醇氧化为乙醛 | |
| C. | 乙烯聚合为聚乙烯 | |
| D. | 光照条件下甲烷与氯气反应制一氯甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 500 | 1000 | 1500 |
| n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
| A. | 平衡不移动 | |
| B. | 重新达到平衡后,再充入的M转化率小于50% | |
| C. | 重新达到平衡后,Y的平均反应速率与原平衡相等 | |
| D. | 重新达到平衡后,用X表示的v(正)比原平衡大 | |
| E. | 重新达到平衡后,混合气体中Y的体积分数增大 | |
| F. | 重新达到平衡后,M的物质的量浓度是原平衡的1.5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料.有着重要的用途和应用前景.
甲醇是一种重要的化工原料.有着重要的用途和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
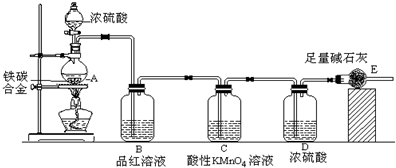
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com