
 将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )
将一定量Mg、Al合金溶于1mol•L-1的HCl溶液中,进而向所得溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示.下列分析的结论中正确的是( )| A. | 无法给出实验中产生H2的物质的量 | |
| B. | 欲给出a的取值范围尚缺少一个条件 | |
| C. | 无法认定Mg、Al合金中$\frac{n(Mg)}{n(Al)}$的最大值 | |
| D. | 溶解“一定量Mg、Al合金”的HCl溶液的体积为90mL |
分析 根据图象可知,在滴加NaOH溶液到体积amL过程中,没有沉淀生成,说明盐酸有剩余,滴加的NaOH用于中和剩余盐酸,在amL时,剩余的HCl与滴加的NaOH恰好完全反应,溶液是MgCl2、AlCl3和NaCl混合液;
继续滴加氢氧化钠溶液,开始生成Mg(OH)2、Al(OH)3沉淀,当加入氢氧化钠溶液80ml时,沉淀量最大,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液,根据钠离子守恒可知n(NaCl)=n(NaOH)=0.08ml×1mol/L=0.08mol.再继续滴加氢氧化钠,在加入90mol时,沉淀物质的量最小,是氢氧化镁沉淀,所以加入10ml氢氧化钠溶解氢氧化铝沉淀,此时溶液为氯化钠、偏铝酸钠溶液,根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.01L×1mol/L=0.01mol.所以沉淀量最大时,根据铝元素守恒,氢氧化铝的物质的量为0.01mol;
A.确定了金属镁和金属铝的量就可以确定生成氢气的量;
B.合金的组成可以采用极限假设法,当金属全部是金属铝时剩余的酸最多,a的值最大来判断a得取值范围;
C.若假设盐酸不剩,即a=0,加入的80ml氢氧化钠溶液用于沉淀Mg2+、Al3+,所以沉淀量最大时,合金中镁元素的物质的量最大,结合氢氧化铝的物质的量,进而确定该合金中两元素物质的量之比的最大值;
D.当加入氢氧化钠溶液80ml时,沉淀量最大,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液,根据钠离子守恒可知n(NaCl)=n(NaOH),根据氯元素守恒,所以n(HCl)=n(NaCl),据此计算判断.
解答 解:根据图象可知,在滴加NaOH溶液到体积amL过程中,没有沉淀生成,说明盐酸有剩余,滴加的NaOH用于中和剩余盐酸,在amL时,剩余的HCl与滴加的NaOH恰好完全反应,溶液是MgCl2、AlCl3和NaCl混合液.
继续滴加氢氧化钠溶液,开始生成Mg(OH)2、Al(OH)3沉淀,当加入氢氧化钠溶液80ml时,沉淀量最大,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液,根据钠离子守恒可知n(NaCl)=n(NaOH)=0.08ml×1mol/L=0.08mol.再继续滴加氢氧化钠,在加入90mol时,沉淀物质的量最小,是氢氧化镁沉淀,所以加入10ml氢氧化钠溶解氢氧化铝沉淀,此时溶液为氯化钠、偏铝酸钠溶液,根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.01L×1mol/L=0.01mol.所以沉淀量最大时,根据铝元素守恒,氢氧化铝的物质的量为0.01mol.
A.由上述分析可知,金属镁的量不确定,无法判断生成氢气的量的多少,故A正确;
B.假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0.通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,所以的取值范围为 0≤a<50,故B错误;
C.若假设盐酸不剩,即a=0,加入的80ml氢氧化钠溶液用于沉淀Mg2+、Al3+,所以沉淀量最大时,合金中镁元素的物质的量最大,根据铝元素守恒,氢氧化铝的物质的量为0.01mol,根据氢氧根守恒可知沉淀中含有氢氧根n(OH-)=n(NaOH)=0.08ml×1mol/L=0.08mol,所以氢氧化镁沉淀为:$\frac{0.08mol-0.01mol×3}{2}$=0.025mol,所以该合金中$\frac{n(Mg)}{n(Al)}$的最大值为2.5,故C错误;
D.由分析可知溶液中,n(NaCl)=n(NaOH)=0.08ml×1mol/L=0.08mol,根据氯元素守恒,所以n(HCl)=n(NaCl)=0.08mol,所以溶解金属的盐酸的体积为$\frac{0.08mol}{1mol/L}$=0.08L=80ml,故D错误;
故选:A.
点评 本题考查镁、铝化合物混合的有关计算,题目难度中等,明确反应过程是解题关键,根据图象分析,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 2.4 mol•L-1 | D. | 3.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合液中c(SO${\;}_{4}^{2-}$)为0.04 mol•L-1 | |
| B. | 原Al2(SO4)3溶液中c(Al3+)与100 mL 0.02 mol•L-1 Al(NO3)3中c(Al3+)相等 | |
| C. | 混合后的溶液中含有0.003 mol Na+ | |
| D. | 混合后溶液中c(Na+)为0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
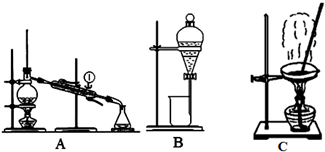
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系压强不变 | B. | 气体平均相对分子质量不变 | ||
| C. | 气体密度不变 | D. | c(CO2):c(CO)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:(部分反应物,产物略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:(部分反应物,产物略去).下列有关物质的推断正确的是( )| A. | 若甲为HNO3,则丁可能是Fe | B. | 若甲为AlCl3,则丁可能是氨水 | ||
| C. | 若甲为焦炭,则丁可能是SiO2 | D. | 若甲为NaOH 溶液,则丁可能是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


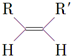 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO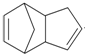 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$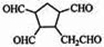 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com