
 ,H2O中含有的化学键为极性键(离子键、极性键、非极性键)
,H2O中含有的化学键为极性键(离子键、极性键、非极性键) 分析 非金属性越强,最高价含氧酸的酸性越强、简单氢化物的稳定性越强;同一周期中原子序数越大原子半径 越小;氨气为共价化合物,分子中含有3个N-H键;水分子为共价化合物,含有H-O为极性键.
解答 解:非金属性S<Cl,则最高价氧化物对应水合物的酸性:H2SO4<HClO4;
Na、Al位于同一周期,原子序数Na<Al,则原子半径:Na>Al;
NH3属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,NH3的电子式为 ;
;
H2O分子属于共价化合物,其分子中中含有的化学键为极性共价键,简称极性键,
故答案为:<;>;>; ;极性键.
;极性键.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,明确元素周期律的内容即可解答,注意掌握常见化学用语的书写原则,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题

| A. | 它们的一氯代物均只有一种 | B. | 它们之间互为同系物 | ||
| C. | 三星烷与乙苯互为同分异构体 | D. | 六星烷的化学式为C18H24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K、Na、Li | B. | Al、Mg、Na | C. | F、Cl、Br | D. | Cl、S、P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量氨水,判断Mg与Al的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2气体,判断碳与硅的非金属性强弱 | |
| D. | Br2与I2分别与足量H2反应,判断溴与碘的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
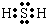 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )| A. | 反应开始2min内,v(A)=0.025mol/(L•mol) | |
| B. | t1时改变的条件可能是升高温度 | |
| C. | t3时改变的条件可能是加压,此时c(B)不变 | |
| D. | t4时可能是使用了催化剂,此时c(B)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 混合物 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴的CCl4溶液 | 分液 |
| B | 溴乙烷(乙醇) | 水 | 分液 |
| C | 淀粉溶液(NaCl) | 水 | 过滤 |
| D | 皂化液(甘油) | NaCl | 盐析,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com