
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
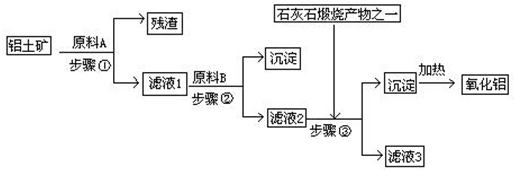
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
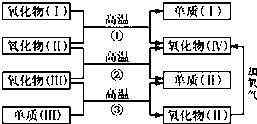 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
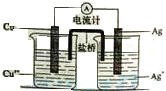 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com