
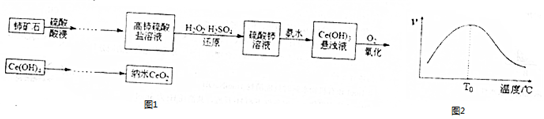
分析 铈矿石加入硫酸酸浸得到高铈硫酸盐,加入过氧化物稀硫酸还原高铈硫酸盐得到硫酸铈溶液,加入氨水生成Ce(OH)2沉淀,通入氧气氧化得到Ce(OH)4,分解得到CeO2,
(1)酸浸过程中,为了加快酸浸速率,可以升温、增大浓度、增大接触面积等措施加快浸出速率;
(2)过氧化氢还原高铈硫酸盐得到硫酸铈溶液;过氧化氢在外地升高时会分解,还原剂浓度减小,反应速率减小;
(3)Ksp[Ce(OH)3]=1.0×10-20,当离子浓度≤1.0×10-5mol/L,认为离子沉淀完全,依据溶度积常数计算得到氢氧根离子浓度;
(4)制备的CeO2是否为纳米级,溶于水利用胶体的丁达尔效应检验;
(5)Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒n[Ce(OH)4]=n[(NH4)2Fe(SO4)2],进而计算产品纯度.
解答 解:(1)将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等都可以加快酸浸速率,
故答案为:将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等;
(2)过氧化氢还原高铈硫酸盐得到硫酸铈溶液,离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,高铈离子被还原的速率与温度的关系如图2所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是:温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢,
故答案为:将高铈硫酸盐还原;2Ce4++H2O2=2Ce3++O2↑+2H+;温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢;
(3)Ksp[Ce(OH)3]=c(Ce3+)c3(OH-)=1.0×10-20,当离子浓度≤1.0×10-5mol/L,c3(OH-)=$\frac{1.0×1{0}^{-20}}{1.0×1{0}^{-5}}$=1.0×10-15,
c(OH-)=1.0×10-5mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,需加入氨水调节溶液pH至少为9,
故答案为:9;
(4)检验制备的CeO2是否为纳米级的方法是利用胶体的特征性质,将产品分散至水中,用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级,
故答案为:用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级;
(5)①待测溶液具有酸性和强氧化性,应用酸式滴定管量取,故答案为:酸式滴定管;
②不能用KSCN作为指示剂,因滴入NH4)2Fe(SO4)2溶液立即变红,不能起到指示滴定终点的作用,
故答案为:不能;滴入NH4)2Fe(SO4)2溶液立即变红,不能起到指示滴定终点的作用;
③Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒:n[Ce(OH)4]=n[(NH4)2Fe(SO4)2]=V×10-3L×cmol•L-1×$\frac{250mL}{20mL}$=0.0125cVmol,则m[Ce(OH)4]=208g/mol×0.0125cVmol=2.6cV g
故样品的纯度为$\frac{2.6cVg}{mg}$×100%=$\frac{2.6cV}{m}$×100%,
故答案为:$\frac{2.6cV}{m}$×100%;
④A.末用标准溶液润洗滴定管,标准溶液浓度减小,消耗体积增大,计算得到结果偏高,故A错误;
B.滴定前俯视计数,终点时仰视计数,测定标注溶液体积增大,测定结果偏高,故B错误;
C.锥形瓶残留有蒸馏水对测定结果无影响,故C错误;
D.盛标准溶液的滴定管尖嘴处,滴定前无气泡,滴定后有气泡,导致所用标准液体积偏小,则浓度偏低,故D正确;
E.标准液在空气中放置时间较久,亚铁离子被氧化,导致浓度偏低,则消耗体积增大,计算得到结果偏高,故E错误.
故答案为:D.
点评 本题考查了物质组成和成分的探究、物质的分离提纯方法、滴定实验过程分析和计算等,为高考常见题型,侧重分析、推断及实验能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:B>C | |
| B. | 氢化物的沸点:B>C | |
| C. | 最高价氧化物对应的水化物的酸性:B>D | |
| D. | A、B、C、D形成的单质最多有6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每次衰变都放出24H | |
| B. | 每次衰变都放出T | |
| C. | ${\;}_{100}^{153}$Fm只是元素镄的一个原子,153不代表镄元素的相对原子质量 | |
| D. | ${\;}_{112}^{277}$CnCn经过3次这样的衰变是得不到镄原子的,产生的是Cn的同位素原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④⑤⑥ | C. | ②③⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯和溴乙烷均能发生加成反应 | |
| B. | 花生油和玉米油都是可皂化的饱和酯类 | |
| C. | 天然气和水煤气的主要成分都是烃类 | |
| D. | 分子式为C10H14的单取代芳烃,其可能的结构有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该氨水的物质的量浓度约为6.3mol•L-1 | |
| B. | 各取5ml与等质量的水混合后,c(H2SO4)<9.2 mol•L-1,c(NH3)>6.45 mol•L-1 | |
| C. | 常温下铁不能与该硫酸反应 | |
| D. | 各取10ml于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com