
| 酸 | HX | HY | HZ |
| K/mol.L-1 | 9×10-7 | 9×10-6 | 2×10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-能够发生 |
| C、相同温度下,0.1mol.L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol.L-1HX溶液的电离常数大于0.1 mol?L?1HX |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH═11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、同浓度同体积的强酸与强碱溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 |
| B、增大压强 |
| C、升高温度同时充入N2 |
| D、用时将CO2和N2从反应体系中移走 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量浓盐酸 |
| B、加入几滴氯化铜溶液 |
| C、加入少量铁粉 |
| D、加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体中不一定含有金属元素 |
| B、晶格能越大,物质的硬度反而越小 |
| C、在含有阳离子的化合物晶体中,一定含有阴离子 |
| D、原子晶体的熔点不一定比金属晶体的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素基态原子中共有7个电子 |
| B、该元素原子核外有3个电子层 |
| C、该元素原子M能层共有5个电子 |
| D、该元素原子最外层可能有1个或2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
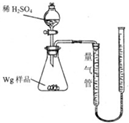 用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为a mL,实验后量气管的最终读数为b mL.
用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为a mL,实验后量气管的最终读数为b mL.| 56×(b-a)×10 -3 |
| W×V m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com