
| A. | ①⑤⑥ | B. | ②④⑥ | C. | ⑤⑥ | D. | ①②③④⑤⑥ |
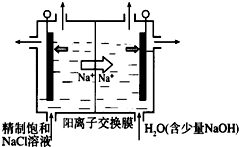
分析 硬水中的Ca2+、Mg2+离子形成的暂时硬度,经煮沸就会完全沉淀下来,但含有氯化物时,不能通过煮沸的方法降低硬度,可用沉淀法或离子交换法降低硬度,以此解答.
解答 解:暂时硬度指水中钙、镁的碳酸氢盐含量,可以用加热煮沸的方法使之沉淀消除;永久硬度是指水中非碳酸盐硬度,包括钙、镁的硫酸盐和氯化物等,硬水中的Ca2+、Mg2+离子形成的暂时硬度,经煮沸就会完全沉淀下来;但永久硬度的水不能加热煮沸除去,可加入磷酸钠生成沉淀而降低硬度,
离子交换法采用特定的阳离子交换树脂,以钠离子将水中的钙镁离子置换出来,由于钠盐的溶解度很高,所以就避免了随温度的升高而造成水垢生成的情况,所以可以软化永久硬水和暂时硬度的水,
故选C.
点评 本题考查物质的分离、提纯,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:解答题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 8.4L | D. | 2.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用一种原子制造出另一种或几种原子 | |
| B. | 碳酸氢铵受热分解 | |
| C. | 蓝矾加热后变为白色固体 | |
| D. | 电解水生成氢气和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L O2一定含有NA个氧分子 | |
| B. | 1mol H2的质量只有在标准状况下才约为2g | |
| C. | 标准状况下,18g水的体积为22.4L | |
| D. | 1mol H2和O2的混合气体在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| C. | 推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com