
分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;
(2)根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;
(4)控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;
(5)从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2Fe3++Fe=3Fe2+;
(2)根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,则溶液pH=-lg1.0×10-2=2,
故答案为:2;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3,故答案为:K1>K2>K3 ;
(4)控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd,
故答案为:bd;
(5)从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH,
故答案为:调节溶液的pH.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
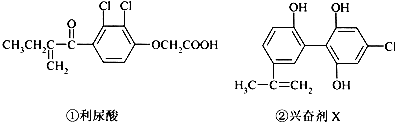
| A. | 在兴奋剂X的水溶液中滴入酸性KMnO4溶液,只氧化分子中的碳碳双键 | |
| B. | 1mol利尿酸与氢反应,最多消耗2molH2 | |
| C. | 兴奋剂X遇到FeCl3溶液显色,利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 兴奋剂X分子中的所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(Na+)>C(X - )>C(H+)>C(OH-) | B. | C(Na+)>C(X-)>C(OH-)>C(H+) | ||
| C. | C(X-)+C(OH-)>C(Na+)+C(H+) | D. | C(X-)>C(Na+)>C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
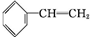 +Br2
+Br2
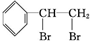 .
.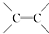 $\stackrel{稀、冷KMnO_{4}/OH-}{→}$
$\stackrel{稀、冷KMnO_{4}/OH-}{→}$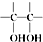 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式 ;
; ;
;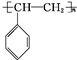 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 ,元素Y在周期表中的位置是第二周期VA族.
,元素Y在周期表中的位置是第二周期VA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com