(2013?南通一模)工业上利用锌焙砂(主要含ZnO、ZnFe
2O
4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示.回答下列问题:
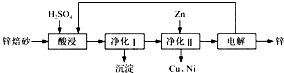
(1)酸浸时ZnFe
2O
4会生成两种盐,该反应的化学方程式为
ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
.
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe
2+氧化;第二步是控制溶液pH,使Fe
3+转化为Fe(OH)
3沉淀.
①写出酸性条件下H
2O
2与Fe
2+反应的离子方程式:
H2O2+2Fe2++2H+═2Fe3++2H2O
H2O2+2Fe2++2H+═2Fe3++2H2O
.
②25℃时,pH=3的溶液中,c(Fe
3+)=
4.0×10-5
4.0×10-5
mol?L
-1(已知25℃,Ksp[Fe( OH)
3]=4.0×10
-38).
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
Fe(OH)3胶体(沉淀)具有吸附性
Fe(OH)3胶体(沉淀)具有吸附性
.
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是
制取的锌含铜等杂质
制取的锌含铜等杂质
.
(4)本流程中可以循环利用的物质除锌外还有
H2SO4、ZnSO4
H2SO4、ZnSO4
.

