
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
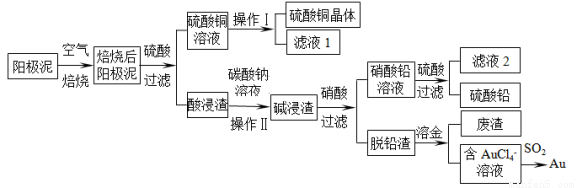
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
(1)Pb-2e-+SO42-=PbSO4 (2分)(答Pb-2e-=Pb2+得1分)
(2)将阳极泥粉碎,逆流焙烧等(2分) CuO (2分)
(3)蒸发浓缩,降温结晶,过滤。(或继续)洗涤,干燥(2分) 过滤(2分)
(4)2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+ (3分)
(5)用滤液2溶解碱浸渣 (或并入硝酸中)。(2分)(利用滤液2,但循环错误的,扣1分)
(6)PbSO4(s)+CO32-(aq)  PbCO3(s)+SO42-(aq) (2分,用“=”不扣分)
PbCO3(s)+SO42-(aq) (2分,用“=”不扣分)
【解析】
试题分析:(1电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活性的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为:Pb-2e-+SO42-=PbSO4。
(2)由题干可知,用于焙烧的阳极泥的成分为Cu、Au(金)和PbSO4 等,所以在被烧过程中铜被氧化为了CuO,而Au(金)和PbSO4 均较稳定。要使焙烧效率提高,合理措施是把得到的阳极泥充分的粉碎,增大接触面积,或把反应后的气体在次逆流焙烧,这样可以升高温度且减少能耗。
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。操作II是从酸浸渣(PbSO4)中得到碱浸渣(PbCO3),因此该操作是过滤操作。
(4)SO2还原AuCl4- 中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42- ,还原产物是Au。因此根据氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,因此得到的反应方程式为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+ 。
(5)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用。因此类似此处的做法,应该是流程中得到的另一滤液2。此滤液2是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤走硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣,或者与前面碱浸渣步骤需要加入的硝酸合并加以利用。
(6)通过比较两种沉淀的溶度积,可以看出碳酸铅比硫酸铅更加难溶,因此往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应,所以离子方程式要注意标明状态,最好弄可逆号,所以方程式为:PbSO4(s)+CO32-(aq)  PbCO3(s)+SO42-(aq)。
PbCO3(s)+SO42-(aq)。
考点:本题考查的简单的化学工艺流程题,主要包括电极反应式、氧化还原反应方程式、溶解平衡表达式的书写。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是
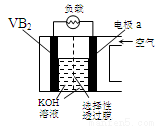
A.电极a为电池负极
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经KOH溶液流向a电极
D.VB2极发生的电极反应为:
2VB2 + 22OH?- 22e?→V2O5 + 2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:选择题
实验室中以下物质的贮存方法不正确的是
A.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
B.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
C.少量金属钠保存在煤油中
D.试剂瓶中的液溴可用水封存,防止溴挥发
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:填空题
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
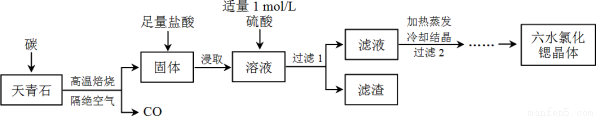
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:选择题
如下实验操作正确且能达到实验目的的是
A.将十水碳酸钠置于蒸发皿中,加热脱去结晶水
B.用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物
C.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集
D.用酸式滴定管量取6.55 mL的KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
下列实验现象对应的结论正确的是( )
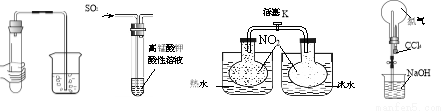
①气密性检查 ②气体性质检验 ③化学平衡的探究 ④喷泉实验
选项 | 现象 | 结论 |
A | ①中导管口冒气泡,手松开无现象 | 气密性良好 |
B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为:

已知:①NaFeO2遇水强烈水解;
②重铬酸钾为橙红色针状晶体,溶于水,不溶于乙醇,有强氧化性;
③2CrO42- + 2H+  Cr2O72-+ H2O
Cr2O72-+ H2O
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)①铬铁矿经粉碎处理的目的是 。
②写出Cr2O3和纯碱、氧气反应生成Na2CrO4的化学方程式为 ;
③NaFeO2水浸时强烈水解生成氢氧化铁沉淀,离子方程式为___ ___。
(3)滤液1的成分除Na2CrO4、NaOH外,还含有(填化学式) ,
(4)通过途径Ⅰ从Na2CrO4溶液获得K2Cr2O7晶体,操作步骤有:“酸化”→加KCl固体→蒸发浓缩→操作a→过滤→洗涤→干燥。
① “酸化”步骤用醋酸调节溶液pH<5,其目的是 ;
②操作a的名称 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
下列有关物质的性质与其应用不相对应的是( )
A.Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品
B.NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂
C.NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏
D.K2FeO4能与水作用生成Fe(OH) 3胶体和O2,可用于自来水的净化和杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:实验题
某化学小组在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下。
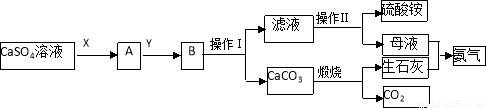
回答下列问题:
(1)操作Ⅰ的名称为_________;操作Ⅱ一系列操作包括蒸发浓缩、________、过滤。
(2)实验室中煅烧碳酸钙时,盛放碳酸钙所用的仪器是________(填名称)。
(3)X物质为____(填化学式,下同),Y物质为____,可循环利用的物质的有_____。
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后称量固体的质量为16.31g。为避免引起误差,检验氯化钡溶液是否过量最好的试剂是_______,所制得硫酸铵的纯度为________。
(5)下列装置不能用于实验室制氨气的是__________(填序号)。
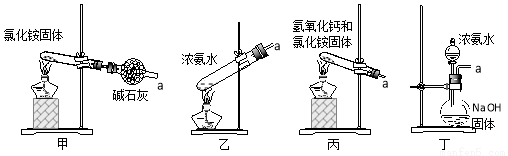
选择氨气的制取装置后,再用下列装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接____,____接____,____接_____,____接_____。

上述装置中CCl4的作用是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com