
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8[来源:www.shulihua.net] | 9.4 |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| c2(OH-) |
| 0.5 |
| 1 |
| 3 |
| Ksp |
| c(OH -)2 |
| 1.8×10-11 |
| 0.0012 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数/% | 12 | 24 | 12 | 16 | 20 | 10 | 6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-389.9 kJ/mol | ||
B、C2H2(g)+
| ||
| C、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol | ||
| D、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-1299.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 转变成
转变成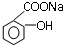 的方法是( )
的方法是( )| A、加入足量的NaOH(aq)并加热 |
| B、与足量NaOH(aq)共热后,通入足量CO2 |
| C、与盐酸共热后,加入足量的NaOH(aq) |
| D、与稀硫酸共热后,加入足量Na2CO3 (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、NO3-、Cl- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Ca2+、K+、OH-、Cl-、NO3- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com