
£Ø12·Ö£©ÉßĪĘŹÆæÉÓĆÓŚÉś²śĒāŃõ»ÆĆ¾£¬¼ņŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
I£®ÖĘČ”“ÖĮņĖįĆ¾£ŗÓĆĖįŅŗ½žÅŻÉßĪĘŹÆæó·Ū£¬¹żĀĖ£»²¢ŌŚ³£ĪĀ³£Ń¹ĻĀ½į¾§£¬ÖʵƓÖĮņĖįĆ¾
£ØĘäÖŠ³£ŗ¬ÓŠÉŁĮæFe3+”¢Al3+”¢Fe2+µČŌÓÖŹĄė×Ó£©”£
II£®Ģį“æ“ÖĮņĖįĆ¾£ŗ½«“ÖĮņĖįĆ¾ŌŚĖįŠŌĢõ¼žĻĀČܽā£¬¼ÓČėŹŹĮæµÄ0.1 mol/L H2O2ČÜŅŗ£¬ŌŁ
µ÷½ŚČÜŅŗpHÖĮ7”«8£¬²¢·ÖĄėĢį“攣
III£®ÖĘČ”ĒāŃõ»ÆĆ¾£ŗĻņ²½ÖčIIĖłµĆČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®”£
ŅŃÖŖ£ŗ½šŹōĄė×ÓĒāŃõ»ÆĪļ³ĮµķĖłŠčpH
| ”” | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| æŖŹ¼³ĮµķŹ± | 1.5 | 3.3 | 6.5 | 9.4 |
| ³ĮµķĶźČ«Ź± | 3.7 | 5.2 | 9.7 | 12.4 |
Ēė»Ų“š£ŗ
£Ø1£©²½ÖčIIÖŠ£¬æÉÓĆÓŚµ÷½ŚČÜŅŗpHÖĮ7~8µÄ×ī¼ŃŹŌ¼ĮŹĒ””””””””””””£ØĢī×ÖÄøŠņŗÅ£©”£
”””” A. MgO”””””””” B. Na2CO3”””””””””” C.ÕōĮóĖ®
£Ø2£©¹¤ŅµÉĻ£¬³£Ķعż²ā¶ØŹ¹ĢśĒč»Æ¼Ų£ØK3[Fe(CN) 6]£©ČÜŅŗ²»±äÉ«ĖłŠčH2O2ČÜŅŗµÄĮæĄ“Č·
¶Ø“ÖĮņĖįĆ¾ÖŠFe2+µÄŗ¬Į攣ŅŃÖŖ£¬²ā¶Ø 123 g“ÖĮņĖįĆ¾ŃłĘ·ĖłĻūŗĵÄ0.1 mol/L H2O2
ČÜŅŗµÄĢå»żČēĻĀ±ķĖłŹ¾”£
| ”” | Ę½ŠŠ²ā¶ØŹż¾Ż | Ę½¾łÖµ | |||
| ŹµŃ鱹ŗÅ | 1 | 2 | 3 | 4 | |
| ĻūŗÄH2O2ČÜŅŗµÄĢå»ż/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
Fe2+ÓėH2O2ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ”””””””””””””””””””””””””£
£Ø3£©¹¤ŅµÉĻ³£ŅŌMg2+µÄ×Ŗ»ÆĀŹĪŖæ¼²ģÖø±ź£¬Č·¶Ø²½ÖčIIIÖʱøĒā
Ńõ»ÆĆ¾¹¤ŅÕ¹ż³ĢµÄŹŹŅĖĢõ¼ž”£ĘäÖŠ£¬·“Ó¦ĪĀ¶ČÓėMg2+×Ŗ»ÆĀŹ
µÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾”£
¢Ł øł¾ŻĶ¼ÖŠĖłŹ¾ 50”ęĒ°ĪĀ¶ČÓėMg2+×Ŗ»ÆĀŹÖ®¼äµÄ¹ŲĻµ£¬æÉÅŠ ¶Ļ“Ė·“Ó¦ŹĒ””””””””£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
¢ŚĶ¼ÖŠ£¬ĪĀ¶ČÉżøßÖĮ 50”ęŅŌÉĻMg2+×Ŗ»ÆĀŹĻĀ½µµÄæÉÄÜŌŅņ ŹĒ”””””””””””””””””””””£
¢ŪKsp±ķŹ¾³ĮµķČܽāĘ½ŗāµÄĘ½ŗā³£Źż”£ŅŃÖŖ£ŗ
Mg(OH)2(s) ””Mg2+ (aq)+ 2OH- (aq)”””””” Ksp = c(Mg2+)”¤c2(OH-) = 5.6”Į10-12
Ca(OH)2(s)””Ca2+ (aq) + 2OH- (aq)”””””” £Ėsp = c(Ca2+)”¤c2(OH-)= 4.7”Į10-6
ČōÓĆŹÆ»ŅČéĢę“ś°±Ė®£¬””””””£ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©ÖʵĆĒāŃõ»ÆĆ¾£¬ĄķÓÉŹĒ”””””””””” ”””””””£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
 ÉßĪĘŹÆæÉÓĆÓŚÉś²śĒāŃõ»ÆĆ¾£¬¼ņŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
ÉßĪĘŹÆæÉÓĆÓŚÉś²śĒāŃõ»ÆĆ¾£¬¼ņŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| æŖŹ¼³ĮµķŹ± | 1.5 | 3.3 | 6.5 | 9.4 |
| ³ĮµķĶźČ«Ź± | 3.7 | 5.2 | 9.7 | 12.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| æŖŹ¼³ĮµķŹ± | 1.5 | 3.3 | 6.5 | 9.4 |
| ³ĮµķĶźČ«Ź± | 3.7 | 5.2 | 9.7 | 12.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| æŖŹ¼³ĮµķŹ± | 1.5 | 3.3 | 6.5 | 9.4 |
| ³ĮµķĶźČ«Ź± | 3.7 | 5.2 | 9.7 | 12.4 |
| Ę½ŠŠ²ā¶ØŹż¾Ż | Ę½¾łÖµ | ||||
| ŹµŃ鱹ŗÅ | 1 | 2 | 3 | 4 | |
| ĻūŗÄ H2O2ČÜŅŗµÄĢå»ż/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģø£½ØŹ”ø߶žĻĀѧʌµŚŅ»“Ī½×¶Īæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©ÉßĪĘŹÆæÉÓĆÓŚÉś²śĒāŃõ»ÆĆ¾£¬¼ņŅŖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
I£®ÖĘČ”“ÖĮņĖįĆ¾£ŗÓĆĖįŅŗ½žÅŻÉßĪĘŹÆæó·Ū£¬¹żĀĖ£»²¢ŌŚ³£ĪĀ³£Ń¹ĻĀ½į¾§£¬ÖʵƓÖĮņĖįĆ¾
£ØĘäÖŠ³£ŗ¬ÓŠÉŁĮæFe3+”¢Al3+”¢Fe2+µČŌÓÖŹĄė×Ó£©”£
II£®Ģį“æ“ÖĮņĖįĆ¾£ŗ½«“ÖĮņĖįĆ¾ŌŚĖįŠŌĢõ¼žĻĀČܽā£¬¼ÓČėŹŹĮæµÄ0.1 mol/L H2O2ČÜŅŗ£¬ŌŁ
µ÷½ŚČÜŅŗpHÖĮ7”«8£¬²¢·ÖĄėĢį“攣
III£®ÖĘČ”ĒāŃõ»ÆĆ¾£ŗĻņ²½ÖčIIĖłµĆČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®”£
ŅŃÖŖ£ŗ½šŹōĄė×ÓĒāŃõ»ÆĪļ³ĮµķĖłŠčpH
|
”” |
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
æŖŹ¼³ĮµķŹ± |
1.5 |
3.3 |
6.5 |
9.4 |
|
³ĮµķĶźČ«Ź± |
3.7 |
5.2 |
9.7 |
12.4 |
Ēė»Ų“š£ŗ
£Ø1£©²½ÖčIIÖŠ£¬æÉÓĆÓŚµ÷½ŚČÜŅŗpHÖĮ7~8µÄ×ī¼ŃŹŌ¼ĮŹĒ””””””””””””£ØĢī×ÖÄøŠņŗÅ£©”£
”””” A. MgO”””””””” B. Na2CO3”””””””””” C.ÕōĮóĖ®
£Ø2£©¹¤ŅµÉĻ£¬³£Ķعż²ā¶ØŹ¹ĢśĒč»Æ¼Ų£ØK3[Fe(CN) 6]£©ČÜŅŗ²»±äÉ«ĖłŠčH2O2ČÜŅŗµÄĮæĄ“Č·
¶Ø“ÖĮņĖįĆ¾ÖŠFe2+µÄŗ¬Į攣ŅŃÖŖ£¬²ā¶Ø 123 g“ÖĮņĖįĆ¾ŃłĘ·ĖłĻūŗĵÄ0.1 mol/L H2O2
ČÜŅŗµÄĢå»żČēĻĀ±ķĖłŹ¾”£
|
”” |
Ę½ŠŠ²ā¶ØŹż¾Ż |
Ę½¾łÖµ |
|||
|
ŹµŃ鱹ŗÅ |
1 |
2 |
3 |
4 |
|
|
ĻūŗÄH2O2ČÜŅŗµÄĢå»ż/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+ÓėH2O2ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ”””””””””””””””””””””””””£
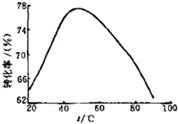
£Ø3£©¹¤ŅµÉĻ³£ŅŌMg2+µÄ×Ŗ»ÆĀŹĪŖæ¼²ģÖø±ź£¬Č·¶Ø²½ÖčIIIÖʱøĒā
Ńõ»ÆĆ¾¹¤ŅÕ¹ż³ĢµÄŹŹŅĖĢõ¼ž”£ĘäÖŠ£¬·“Ó¦ĪĀ¶ČÓėMg2+×Ŗ»ÆĀŹ
µÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾”£
¢Ł øł¾ŻĶ¼ÖŠĖłŹ¾ 50”ęĒ°ĪĀ¶ČÓėMg2+×Ŗ»ÆĀŹÖ®¼äµÄ¹ŲĻµ£¬æÉÅŠ ¶Ļ“Ė·“Ó¦ŹĒ””””””””£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
¢ŚĶ¼ÖŠ£¬ĪĀ¶ČÉżøßÖĮ 50”ęŅŌÉĻMg2+×Ŗ»ÆĀŹĻĀ½µµÄæÉÄÜŌŅņ ŹĒ”””””””””””””””””””””£
¢ŪKsp±ķŹ¾³ĮµķČܽāĘ½ŗāµÄĘ½ŗā³£Źż”£ŅŃÖŖ£ŗ
Mg(OH)2(s)  ””Mg2+ (aq)+ 2OH- (aq)”””””” Ksp = c(Mg2+)”¤c2(
OH-) = 5.6”Į10-12
””Mg2+ (aq)+ 2OH- (aq)”””””” Ksp = c(Mg2+)”¤c2(
OH-) = 5.6”Į10-12
Ca(OH)2(s) ””Ca2+ (aq) + 2OH- (aq)”””””” £Ėsp = c(Ca2+)”¤c2(OH-)
= 4.7”Į10-6
””Ca2+ (aq) + 2OH- (aq)”””””” £Ėsp = c(Ca2+)”¤c2(OH-)
= 4.7”Į10-6
ČōÓĆŹÆ»ŅČéĢę“ś°±Ė®£¬””””””£ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©ÖʵĆĒāŃõ»ÆĆ¾£¬ĄķÓÉŹĒ ”””””””””” ”””””””£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com