
分析 酸性条件下,硝酸根离子具有强氧化性,且氧化性NO3->Fe3+,还原性Fe2+>NH4+,所以该反应中氧化剂是NO3-,还原剂是Fe2+,反应物中还含有H+,根据元素守恒知,生成物中还含有H2O,发生反应为8Fe2++NO3-+10H+=8Fe3++NH4++H2O,再结合物质的性质结合各个物理量之间的关系式计算.
解答 解:酸性条件下,硝酸根离子具有强氧化性,且氧化性NO3->Fe3+,还原性Fe2+>NH4+,所以该反应中氧化剂是NO3-,还原剂是Fe2+,反应物中还含有H+,根据元素守恒知,生成物中还含有H2O,发生反应为8Fe2++NO3-+10H+=8Fe3++NH4++H2O,该反应中N元素化合价由+5变为-3价、Fe元素化合价由+2价变为+3价,所以氧化剂是NO3-、还原剂是Fe2+,还原剂和氧化剂的物质的量之比为8:1,
故答案为:Fe2+;NO3-;8:1.
点评 本题考查了氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,根据元素化合价及氧化性、还原性强弱正确判断反应物和生成物是解本题关键,再结合方程式分析解答,难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:实验题
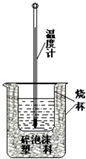 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
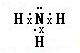 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| B. | 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 | |
| C. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| D. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
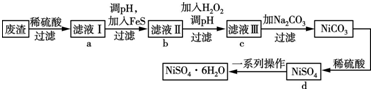
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
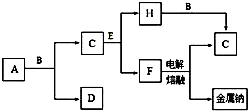 中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
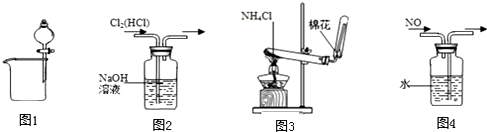
| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com