
【题目】软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
【答案】将矿石粉碎、加热、搅拌等3MnO2+2FeS+6H2SO4 Fe2(SO4)3+3MnSO4+2S↓+6H2OCu、Cd将Fe2+氧化为Fe3+ACLi1-xMnO2+xLi++xe-=LiMnO2CN-+H2S=HCN+HS-5
【解析】软锰矿、闪锌矿和稀硫酸混合,发生的反应有MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、MnO2+FeS+2H2SO4=MnSO4+FeSO4+S↓+2H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+CdS+2H2SO4=MnSO4+CdSO4+S↓+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不溶于稀硫酸,然后过滤,滤液中含有MnSO4、FeSO4、CuSO4、CdSO4、Al2(SO4)3,向滤液中加入Zn,Zn能还原Cu2+、Cd2+得到Cu、Cd,过滤向滤液中加入二氧化锰和X,二氧化锰具有氧化性,能氧化还原性离子Fe2+,X能使溶液中铁离子、铝离子反应生成沉淀,则X能和氢离子反应且不能引进新的杂质;电解硫酸锌和硫酸锰溶液得到Zn、MnO2和稀硫酸;
(1)步骤①中通常通过将固体粉碎、加热、搅拌等方法,来加快硫酸的浸取速率;①中MnO2、FeS与硫酸共热时有淡黄色S物质析出,溶液变为棕黄色,说明有Fe3+生成,发生反应的化学方程式为3MnO2+2FeS+6H2SO4 Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)根据流程图中反应前后离子变化确定回收金属成分为Cu、Cd;
(3)二氧化锰具有氧化性,能氧化还原性离子亚铁离子,然后将铁离子除去;X能和氢离子反应而调节溶液的pH,且不能引进新的杂质,符合条件的有ZnO和MnCO3,一水合氨和NaOH虽然能调节溶液的pH但引进新的杂质,故答案为AC;
(4)锂离子电池的正极发生还原反应,根据电池反应Li1-xMnO2+LixC6=LiMnO2+6C,可知正极电极反应式为Li1-xMnO2+xLi++xe-=LiMnO2 ;
(5)根据HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,可知酸性强弱顺序为HS-<HCN<H2S,则向NaCN溶液中通入少量的H2S气体,反应的离子方程式为CN-+H2S=HCN+HS-;当含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,Mn2+开始沉淀时Ksp(MnS)=c(S2-)×c(Mn2+)=1.4×10―15,c(S2-)=7×10―14,此时溶液中HS―浓度为1.0×10―4 mol·L―1,K2=7.0×10―15=[c(S2-)×c(H+)]÷c(HS-),解得c(H+)=1.0×10―5,此时溶液pH=5。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是
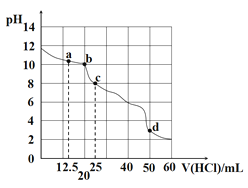
A.a点:c(A2-)=c(HA-)
B.b点:5c(Cl-)=4[c(A2-)+c(HA-)+c(H2A)]
C.c点:c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.d点:c(H+)=c(HA-)+c(A2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18O B. 生成的水分子中含有18O
C. 可能生成45g乙酸乙酯 D. 不可能生成90g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+ O2![]() 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3![]() MnO+ CO2;②2MnO +O2
MnO+ CO2;②2MnO +O2![]() 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,碳酸锰热分解反应的平衡常数K=________(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2的关系为_________________。
(2)反应②在低温下能自发进行,则其△H__________0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示

则下列说法错误的是
A. 醋酸的电离程度:a<b<c
B. 溶液的pH值:b<a<c
C. 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D. 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数递增的5种短周期元素,原子半径按D、E、B、C、A递减,B、E同主族,则下列推断正确的是( )
A. A、B、E-定处于三个不同的短周期
B. A、D不可能在同一主族
C. C的最高价氧化物对应的水化物可能显碱性
D. C和D的单质不可能化合成1:1型离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A. 乙醇中含乙酸杂质,可加入碳酸钠溶液洗涤、分液除去
B. 苯、溴水、铁粉混合制成溴苯
C. 用高锰酸钾酸性溶液来区别甲烷和乙烯
D. 可用分液漏斗分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 G(异戊酸薄荷醇酯)是一种治疗心脏病的药物。其合成线路如下:
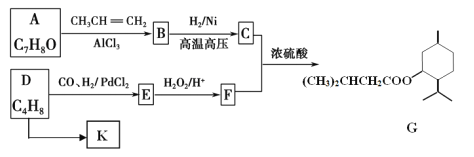
已知:①RCH=CH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
②A能与 FeCl3发生显色反应, K是高分子化合物
③![]()
请填写下列空白:
(1)F中官能团名称_____,A到B的反应类型________。
(2)写出C和F反应生成G的化学方程式___________。
(3)下列说法正确的是_______。
A.有机物 G 的分子式为 C15H28O2
B.有机物 A 溶液能与 Na2CO3 溶液反应产生 CO2
C.有机物 C 不能与浓溴水反应生成白色沉淀
D.有机物 D 生成 K 的反应为缩聚反应
(4)某芳香族化合物 X是B的同分异构体,X分子中含有4种不同化学环境的氢原子,其对应的个数比为 9:2:2:1,写出该化合物可能的结构简式_________。
(5)正戊酸的化学式为CH3(CH2)3COOH,可用作香料、橡胶促进剂等,写出以正丁醇(CH3CH2CH2CH2OH)为原料制备正戊酸的合成路线流程图(无机试剂任用)。
__________
合成路线流程图示例如下:
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com