
| 试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响. |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
 此空删去.
此空删去.分析 (1)根据实验的目的和影响化学反应速率的因素来设计实验;
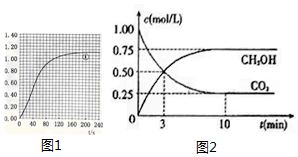
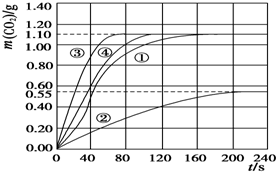
(2)由CO2质量随时间变化的关系图得出70-90s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在70-90s范围内HNO3的平均反应速率;
(3)根据②、③的硝酸用量及温度、大理石规格,对比①画出实验②和③中CO2质量随时间变化关系的预期结果示意图;
(4)①结合化学平衡三行计算列式计算得到,转化率=$\frac{消耗量}{起始量}$×100%,反应速率v=$\frac{△c}{△t}$;
②根据化学平衡时正逆反应速率相等,各组分含量保持不变分析各选项;
解答 解:(1)由实验目的可知,探究浓度、接触面积对化学反应速率的影响,
则实验①②的温度、大理石规格相同,只有浓度不同,实验①③中只有温度不同,实验①④中只有大理石规格不同,故答案为:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | (Ⅱ)③; (Ⅲ)④. | |||
| ② | ||||
| ③ | ||||
| ④ |
 ,
, ;
;点评 本题考查化学反应速率的影响因素、化学反应速率的计算,化学平衡的特征等,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
 的分子式为C2H8O.
的分子式为C2H8O.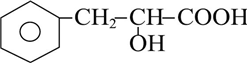 中官能团的名称羟基、羧基.
中官能团的名称羟基、羧基. .
. )为苯的同分异构体,M的二氯代物的同分异构体有3种.
)为苯的同分异构体,M的二氯代物的同分异构体有3种.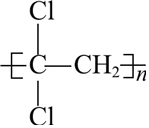 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由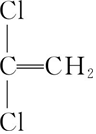 (写结构简式)发生加聚反应生成的.
(写结构简式)发生加聚反应生成的.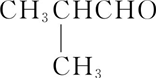 )与新制的氢氧化铜悬浊液共热的化学方程式:
)与新制的氢氧化铜悬浊液共热的化学方程式: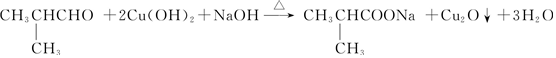 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| B. | 向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 | |
| C. | 置换反应不一定都是氧化还原反应 | |
| D. | 标况下,NA个SO2分子和NA个SO3分子体积相同(NA表示阿伏加德罗常数值) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
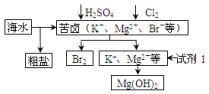 海洋约占地球表面积的71%,对其开发利用的部分流程如图所示.
海洋约占地球表面积的71%,对其开发利用的部分流程如图所示.| A. | ①③④⑥ | B. | ②③④⑥ | C. | ①③④⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
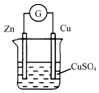 现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.
现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中钙元素的化合价为+4 | |
| D. | 过氧化钙中属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应制取四氯化碳 | |
| B. | 氯乙烯加聚制取聚氯乙烯高分子材料 | |
| C. | 以铜和浓硫酸为原料制取硫酸铜 | |
| D. | 苯和浓硝酸、浓硫酸的混合物在一定条件下反应制取硝基苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com