铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al
2O
3(s)+AlCl
3(g)+3C(s)═3AlCl(g)+3CO(g)△H=+a kJ?mol
-13AlCl(g)═3Al(l)+AlCl
3(g)△H=+b kJ?mol
-1则反应Al
2O
3(s)+3C(s)═2Al(l)+3CO(g)△H=
kJ?mol
-1(用含a、b的代数式表示).
(2)Al
4C
3是真空碳热还原-氯化法反应过程的中间产物,它可以与盐酸反应制取CH
4,某新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH
4和O
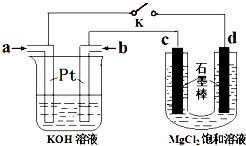
2,电解质为KOH溶液.某研究小组用该甲烷燃料电池作为电源,进行电解饱和MgCl
2溶液的实验,如图1所示.
回答下列问题:
①闭合K开关后,c、d电极上均有气体产生.其中c电极产生的气体能使湿润的淀粉碘化钾试纸变蓝.则b处通入的气体为
,负极上发生的电极反应式为
.
②电解氯化镁溶液的离子反应方程式为
;
③若甲烷通入量为224mL(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l0
4C?mol
-1),如果电能利用率为75%,则能产生的氯气体积为
mL(标准状况).
(3)镁铝合金(Mg
17Al
12)是一种潜在的贮氢材料,可在氩气氛围中,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为:Mg
17Al
12+17H
2═17MgH
2+12Al.得到物质的量之比为17:12的MgH
2和Al的混合物Y,Y在一定条件下释放出氢气.
①熔炼制备镁铝合金(Mg
17Al
12)时通入氩气的目的是
.
②在6.0mol/L HCl溶液中,混合物Y能完全释放出H
2.1mol Mg
17Al
12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H
2的物质的量为
.
③25℃时在②所得溶液中加入适量的NaOH溶液至沉淀恰好不再变化,过滤得滤液.测得滤液的pH为13.则该溶液中由水电离出的c(OH
-)为
.



 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案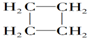 互为同系物
互为同系物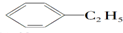 和
和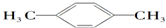 互为同分异构体
互为同分异构体 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.