
 �������������������������������ӦΪ��2NO2��g��+O3��g��?N2O5��g��+O2��g����H����ͬ�¶��£������������з���������Ӧ�������Ϣ���±���ͼ��ʾ������˵����ȷ���ǣ�������
�������������������������������ӦΪ��2NO2��g��+O3��g��?N2O5��g��+O2��g����H����ͬ�¶��£������������з���������Ӧ�������Ϣ���±���ͼ��ʾ������˵����ȷ���ǣ�������| ���� | �� | �� | �� |
| �ݻ�/L | 1 | 1 | 2 |
| ��Ӧ����ʼ�� | 2mol NO2��1mol O3 | 2mol NO2��1mol O3 | 2mol NO2��1mol O3 |
| �¶� | T1 | T2 | T2 |
| A�� | 0��10min�ڼ������з�Ӧ��ƽ�����ʣ�v��NO2��=0.02mol•L-1•min-1 | |
| B�� | T1��T2����H��0 | |
| C�� | ƽ��ʱN2O5Ũ�ȣ�c����N2O5����c����N2O5�� | |
| D�� | T1��ʱ������ʼʱ�����������г���2molNO2��1molO3��2molN2O5��2mol O2����������Ӧ�ﵽƽ��ǰ��v��������c���棩 |
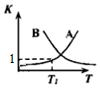
���� A��ͼ�������֪��N2O5��g������Ũ��0.2mol/L��������NO2Ũ��0.4mol/L������v=$\frac{��c}{��t}$����v��NO2����
B����ͼ��������ȹ���ƽ��ֵ�����ҵ��¶Ƚϸߣ�T1��T2���¶�Խ��N2O5��g��Ũ��ԽС��˵����Ӧ�����ƶ�������Ӧ�Ƿ��ȷ�Ӧ��
C��������м�����ʽ����Ũ�ȣ���ѧ��Ӧ�ﵽƽ��״̬���ܽ��г�������
D������ʼʱ���������г���2molNO2��1molO3��2molN2O5��2mol O2������Ũ����Qc��ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
��� �⣺A����ͼ��0��10min�ڼ�������N2O5��Ũ�ȱ仯��Ϊ0.2mol•L-1��2NO2��g��+O3��g��?N2O5��g��ʮO2��g����������NO2Ũ��0.4mol/L����Ӧ����v��NO2��=$\frac{0.4mol/L}{10min}$=0.04mol/��L•min������A����
B����ͼ���֪�����ȴﵽƽ�⣬ƽ���N2O5��g��Ũ�ȱȼ�С�������ȹ���ƽ��ֵ�����ҵ��¶Ƚϸߣ�T1��T2��ƽ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ����H��0����B����
C���������ݻ�ѧ���м���õ���
2NO2��g��+O3?N2O5��g��+O2��g����
2 1 0 0
0.8 0.4 0.4 0.4
1.2 0.6 0.4 0.4
����2NO2��g��+O3?N2O5��g��+O2��g����
1 2 0
ƽ��ʱN2O5Ũ�ȣ�c����N2O5����c����N2O5������C����
D������ʼʱ���������г���2molNO2��1molO3��2molN2O5��2mol O2������Ũ����Qc=$\frac{2��2}{{2}^{2}��1}$�൱�ڼ���������������Ӧ������У���������Ӧ�ﵽƽ��ǰ��v��������v���棩����D��ȷ��
��ѡ��D
���� ���⿼���˻�ѧƽ�⡢��ѧ��Ӧ����Ӱ�����صķ���Ӧ�ã�ͼ��仯����ֵ�ļ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  Ϊ��ʴƷ�����ĸ�ʴ | B�� |  �ж����ʣ������ж� | ||
| C�� |  Ϊ��ȼ���ʣ����Ļ��� | D�� |  Ϊ��ը�����ʣ����ı�ը |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ̼���γ���������Ԫ��֮һ�����ຬ̼���ʶ����༫����Ҫ��
̼���γ���������Ԫ��֮һ�����ຬ̼���ʶ����༫����Ҫ��| ʱ��/min | 0 | 10 | 20 | 30 |
| n��C8H10��/mol | 0.40 | 0.30 | 0.26 | n2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A�� | 0��5min ʱ��H2O��g����ʾ��ƽ����Ӧ����Ϊ1.2��10-3 mol/�� L��min�� | |
| B�� | 5min��10min �ı���������ټ�����0.1mol H2O��g�� | |
| C�� | 200��ʱ�����������г���0.01mol CO��g����0.01mol H2O��g����0.01molCO2��g����0.01molH2��g������ƽ��ʱ��CO��g��Ϊ1.2��10-3mol/L | |
| D�� | 300��ʱ�����������г���0.01mol CO��g����0.01mol H2O��g����0.02molCO2��g����0.02molH2��g������ʼ��Ӧʱ�ͣ��������ͣ��棩 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����£�����AgCl����ı�����Һ��������ˮϡ�ͣ�c��Ag+����Ksp��AgCl�������ֲ��� | |
| B�� | pH=5��CH3COOH��CH3COONa�Ļ����Һ�У�c��Na+����c��CH3COO-�� | |
| C�� | ��0.2mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������ϣ���Ӧ��Ļ����Һ�У�2c��OH-��+c��CH3COO-��=2c��H+��+c��CH3COOH�� | |
| D�� | ��ˮ������У��ܴٽ�ˮ�ĵ��룬Kw����pH������Һ�ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| CO�������% Ͷ�ϱ� | �¶�/�� | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n��{H}_{2}0��}{n��C0��}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
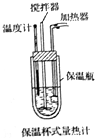 ��ѧ��Ӧ���������ǰ����������ı仯������������ת����
��ѧ��Ӧ���������ǰ����������ı仯������������ת�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com