
下列热化学方程式书写正确的是(△H的绝对值均正确)( )
|
| A. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=﹣1367.0kJ/mol(燃烧热) |
|
| B. | S(s)+O2(g)=SO2(g)△H=﹣269.8kJ/mol(反应热) |
|
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) |
|
| D. | Fe+S=FeS△H=﹣95.6kJ/mol(反应热) |
| 热化学方程式. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量; B、硫燃烧生成二氧化硫的反应是放热反应,热化学方程式要标明物质聚集状态; C、中和热是强酸强碱稀溶液中和反应生成1mol水时放出的热量; D、热化学方程式要标明物质聚集状态. |
| 解答: | 解:A、燃烧热是1mol可燃物完全燃烧生成最稳定氧化物放出的热量;反应中生成的水为气体不是稳定氧化物,故A错误; B、硫燃烧生成二氧化硫气体放热,选项符合热化学方程式书写方法,故B正确; C、中和热是强酸强碱稀溶液中和反应生成1mol水时放出的热量,焓变是负值,故C错误; D、热化学方程式未标注物质聚集状态,故D错误; 故选B. |
| 点评: | 本题考查了热化学方程式书写方法,主要是燃烧热、中和热的概念理解和判断,注意热化学方程式书写方法和原则,题目难度中等. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
A. 18gH2O含10NA个电子
B. 标况下1molH2O体积22.4L
C. 11.2LCH4物质的量一定为0.5mol
D. 标况下22.4LH2含NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=-4b kJ·mol-1
B.C2H2(g)+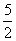 O2(g)===2CO2(g)+H2O(l)
O2(g)===2CO2(g)+H2O(l)
ΔH=+2b kJ·mol-1
C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=-2b kJ·mol-1
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=+b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
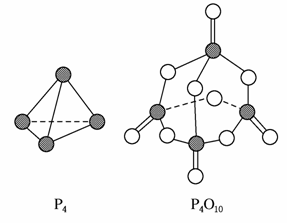
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12d-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+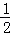 O2(g)=H2O(l)△H=﹣285.8kJ/mol
O2(g)=H2O(l)△H=﹣285.8kJ/mol
CO(g)+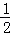 O2(g)=CO2(g)△H=﹣282.6kJ/mol
O2(g)=CO2(g)△H=﹣282.6kJ/mol
C8H18(l)+ O2(g)=8CO2(g)+9H2O(l)△H=﹣5472kJ/mol
O2(g)=8CO2(g)+9H2O(l)△H=﹣5472kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣889.6kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
|
| A. | H2(g) | B. | CO(g) | C. | C8H18(l) | D. | CH4(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能加快其反应速率的是( )
|
| A. | 保持体积不变,充入N2使体系压强增大 |
|
| B. | 增加C的量 |
|
| C. | 保持压强不变,充入N2使容器体积变大 |
|
| D. | 将容器的体积缩小一半 |
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:填空题
(6分)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol·L-1,从中取出100mL溶液,其中Cl-的浓度为 mol·L-1;
再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末考试化学试卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1 600
2Z,其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com